题目内容
5.在标准状况下,将NO2、NO、O2混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器内HNO3的物质的量浓度的大小范围是( )| A. | $\frac{1}{28}$<c(HNO3)<$\frac{1}{22.4}$ | B. | $\frac{1}{39.2}$<c(HNO3)<$\frac{1}{22.4}$ | ||
| C. | $\frac{1}{39.2}$<c(HNO3)<$\frac{1}{28}$ | D. | $\frac{1}{44.8}$<c(HNO3)<$\frac{1}{22.4}$ |
分析 将NO、NO2、O2三种气体按一定比例充满一固定容积的容器,并将该容器倒置在水槽中,充分反应后,容器中无气体剩余,可能发生反应4NO2+O2+2H2O=4HNO3或4NO+3O2+2H2O=4HNO3,所得溶液为HNO3溶液,利用端值法进行讨论测出硝酸的物质的量浓度范围.
解答 解:在标准状况下,将NO2、NO、O2混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,说明气体完全反应,
若混合气体是NO2和O2,且体积比为4:1则发生反应:4NO2+O2+2H2O=4HNO3,生成硝酸的物质的量是溶于水的气体物质的量的$\frac{4}{5}$,所得溶液的体积等于溶于水的气体体积,所以所得溶液的物质的量浓度为:c(HNO3)=$\frac{4}{5×22.4}$mol/L=$\frac{1}{28}$mol/L;
若混合气体是NO和O2,且二者体积比为4:3则发生反应:4NO+3O2+2H2O=4HNO3,生成硝酸的物质的量是溶于水的气体物质的量的$\frac{4}{7}$,所得溶液体积等于溶于水的气体体积,所得溶液的物质的量浓度为:c(HNO3)=$\frac{4}{7×22.4}$moL/L=$\frac{1}{39.2}$mol/L,
由于是NO2、NO、O2三者的混合气体,故c(HNO3)的大小范围应是:$\frac{1}{39.2}$<c(HNO3)<$\frac{1}{28}$,
故选C.
点评 本题考查范围讨论的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握极值法在化学计算中的应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
15.下列变化中,符合周期表中同一周期主族元素从左到右递变规律的是( )
| A. | 原子序数依次增加 | B. | 原子核外电子层数依次增加 | ||
| C. | 原子得电子能力逐渐减弱 | D. | 金属性逐渐增加 |
13.下列叙述正确的是( )
| A. | 分子式为C3H6的有机物最多存在3个碳碳单键,与C4H10的碳碳单键数相同 | |
| B. |  和 和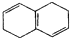 均是芳香烃, 均是芳香烃,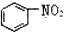 是芳香族化合物 是芳香族化合物 | |
| C. |  和 和 分子组成相差一个-CH2-,因此是同系物 分子组成相差一个-CH2-,因此是同系物 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5OH |
20.BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,合成方法有如下两种:

下列说法正确的是( )

下列说法正确的是( )
| A. |  与BHT互为同系物 与BHT互为同系物 | B. |  属于芳香烃 属于芳香烃 | ||
| C. | BHT不能使酸性高锰酸钾溶液褪色 | D. | 两种方法的反应类型都是加成反应 |
10.下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
②海水苦卤中加入熟石灰,过滤、除去杂质后得到氢氧化镁,以便进一步提取金属镁
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶
④除去溴苯中少量的溴:加入氢氧化钠溶液洗涤、分液.
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
②海水苦卤中加入熟石灰,过滤、除去杂质后得到氢氧化镁,以便进一步提取金属镁
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶
④除去溴苯中少量的溴:加入氢氧化钠溶液洗涤、分液.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
17.海水中含有氯化镁,是镁和氯气的重要来源之一.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳反应,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥产物;④处理得到的产物,得到镁.关于提取镁的下列说法不正确的是( )
| A. | 此法的优点之一是原料来源丰富 | |
| B. | 进行第①②③步骤的目的是从海水中提取氯化镁 | |
| C. | 第④步处理的方法是:用CO将③得到的产物还原,得到镁 | |
| D. | 以上提取镁的过程中涉及到的反应有分解反应、化合反应和置换反应 |
14.下列实验操作或对实验事实的描述正确的是( )
| A. | 欲将蛋白质从水中析出而又不改变它的性质,可加入AgNO3溶液 | |
| B. | 乙醇可以被氧化为乙酸,二者都能发生酯化反应 | |
| C. | 淀粉溶液中加入一定量稀硫酸,共热一段时间后,向溶液中加入新制氢氧化铜悬浊液并加热煮沸,未见红色固体产生,证明淀粉没有发生水解 | |
| D. | 可用NaOH溶液除去混在乙酸乙酯中的乙酸 |
15.下列说法中正确的是( )
| A. | 金刚石晶体中的最小碳原子环由6个碳原子构成 | |
| B. | 金刚石晶体中的碳原子是sp2杂化的 | |
| C. | 12g金刚石中含有C-C键的个数为4NA | |
| D. | 金刚石化学性质稳定,即使在高温下也不会和O2反应 |