题目内容
13.下列叙述正确的是( )| A. | 分子式为C3H6的有机物最多存在3个碳碳单键,与C4H10的碳碳单键数相同 | |
| B. |  和 和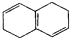 均是芳香烃, 均是芳香烃,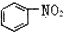 是芳香族化合物 是芳香族化合物 | |
| C. | 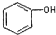 和 和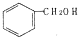 分子组成相差一个-CH2-,因此是同系物 分子组成相差一个-CH2-,因此是同系物 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5OH |
分析 A.分子式为C3H6有机物中,环丙烷分子中含有的碳碳键最多,含有3个碳碳键;分子式为C4H10的有机物为丁烷,分子中也含有3个碳碳键;
B.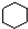 为环己烷,不是苯环,不属于芳香烃;
为环己烷,不是苯环,不属于芳香烃; 中含有氧原子,为烃的衍生物,不属于烃类;
中含有氧原子,为烃的衍生物,不属于烃类;
C. 为苯酚,属于酚类,而
为苯酚,属于酚类,而 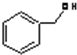 为苯甲醇,二者结构不同,一定不属于同系物;
为苯甲醇,二者结构不同,一定不属于同系物;
D.乙醇和二甲醚中都含有有C-H键和C-O键,无法根据红外光谱图上发现有C-H键和C-O键的振动吸收确定C2H6O的结构简式.
解答 解:A.分子式为C3H6有机物中,含有碳碳键最多的为环丙烷,环丙烷中含3个C-C单键,分子式为C4H10的有机物为丁烷,丁烷分子中也含有3个碳碳键,所以二者含有的碳碳单键数相同,故A正确;
B.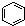 为芳香烃,而
为芳香烃,而 分子中不含苯环,不属于芳香烃,
分子中不含苯环,不属于芳香烃, 中含有氧原子,属于芳香化合物,不属于芳香烃,故B错误;
中含有氧原子,属于芳香化合物,不属于芳香烃,故B错误;
C. 含有酚羟基,为苯酚,属于酚类,而
含有酚羟基,为苯酚,属于酚类,而  含有醇羟基,为苯甲醇,属于醇类,二者结构不同,所以二者一定不属于同系物,故C错误;
含有醇羟基,为苯甲醇,属于醇类,二者结构不同,所以二者一定不属于同系物,故C错误;
D.乙醇(C2H5-OH)和二甲醚(CH3-O-CH3)分子中都存在C-H键和C-O键,所以无法根据红外光谱图上发现有C-H键和C-O键的振动吸收,判断该有机物的结构简式,故D错误;故选A.
点评 本题考查了有机物结构与性质、同系物、芳香烃的判断,题目难度不大,注意掌握常见有机物结构与性质,明确芳香烃、同系物的概念及正确的判断方法.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 甲烷和乙醇均能发生取代反应 | |
| B. | 蛋白质、淀粉、油脂均能发生水解反应 | |
| C. | 溴乙烷与NaOH水溶液共热生成乙烯 | |
| D. | 油脂和淀粉都是高分子化合物 |
4.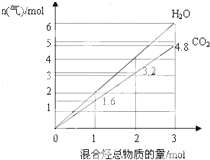 由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )
由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )
 由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )
由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )| A. | 可能有乙烯 | B. | 一定有甲烷 | C. | 可能有丙烷 | D. | 一定没有丙烯 |
1.如表物质所属的类别及其所含官能团的对应关系可能有错误的是( )
| 物质 | 类别 | 官能团 | |
| A | CH3CH=CH2 | 烯烃 |  |
| B | (CH3)2 CHCOOH | 羧酸 | -COOH |
| C | HCOOCH2- | 酯类 | -COOR |
| D | R-OH(R,烃基) | 醇类 | -OH |
| A. | A | B. | B | C. | C | D. | D |
8.生活中的一些问题常涉及到化学知识,下列叙述正确的是( )
| A. | 苯、汽油、无水乙醇都是纯净物 | |
| B. | 甘油易溶于水,可用于制炸药TNT | |
| C. | 福尔马林和苯酚都是良好的杀菌剂,都可用于饮用水及环境消毒 | |
| D. | 室内装饰材料中缓慢释放出的甲醛、苯等有机物会污染空气 |
5.在标准状况下,将NO2、NO、O2混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器内HNO3的物质的量浓度的大小范围是( )
| A. | $\frac{1}{28}$<c(HNO3)<$\frac{1}{22.4}$ | B. | $\frac{1}{39.2}$<c(HNO3)<$\frac{1}{22.4}$ | ||
| C. | $\frac{1}{39.2}$<c(HNO3)<$\frac{1}{28}$ | D. | $\frac{1}{44.8}$<c(HNO3)<$\frac{1}{22.4}$ |
3.已知汽车尾气无害化处理反应为:2NO(g)+2CO (g)?N2(g)+2CO2(g).下列说法错误的是( )
| A. | 通入大量 NO,ν 正、ν 逆 均增大 | |
| B. | 恒温恒容下充入 Ne,ν 正、ν 逆 均不变 | |
| C. | ν 正(NO)=2ν 逆(N2)时,反应达到平衡 | |
| D. | n (NO):n (CO):n (N2):n (CO2)=2:2:1:2 时,反应达到平衡 |
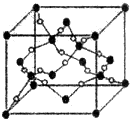 A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.
A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.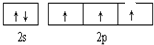 ,与AC3分子互为等电子体的阳离子为H3O+;
,与AC3分子互为等电子体的阳离子为H3O+;