题目内容
10.下列除去杂质的方法正确的是( )①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
②海水苦卤中加入熟石灰,过滤、除去杂质后得到氢氧化镁,以便进一步提取金属镁
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶
④除去溴苯中少量的溴:加入氢氧化钠溶液洗涤、分液.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
分析 ①乙烷与氯气在光照条件下发生取代反应;
②苦卤中含有Mg2+,向其中加入熟石灰后可制得氢氧化镁;
③CO2和SO2都与饱和碳酸钠溶液反应;
④溴可与氢氧化钠反应.
解答 解:①乙烷与氯气在光照条件下发生取代反应,应用溴水除杂,故①错误;
②苦卤中含有Mg2+,向其中加入熟石灰后可制得氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,电解氯化镁可得到镁,故②正确;
③CO2和SO2都与饱和碳酸钠溶液反应,应用饱和碳酸氢钠溶液除杂,故③错误;
④溴可与氢氧化钠反应,而溴苯不溶于水,可分离,故④正确.
故选B.
点评 本题考查物质的分离、提纯,为考查常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,除杂时不能引入新的杂质,且不能影响被提纯物质的性质,难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
1.如表物质所属的类别及其所含官能团的对应关系可能有错误的是( )
| 物质 | 类别 | 官能团 | |
| A | CH3CH=CH2 | 烯烃 |  |
| B | (CH3)2 CHCOOH | 羧酸 | -COOH |
| C | HCOOCH2- | 酯类 | -COOR |
| D | R-OH(R,烃基) | 醇类 | -OH |
| A. | A | B. | B | C. | C | D. | D |
5.在标准状况下,将NO2、NO、O2混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器内HNO3的物质的量浓度的大小范围是( )
| A. | $\frac{1}{28}$<c(HNO3)<$\frac{1}{22.4}$ | B. | $\frac{1}{39.2}$<c(HNO3)<$\frac{1}{22.4}$ | ||
| C. | $\frac{1}{39.2}$<c(HNO3)<$\frac{1}{28}$ | D. | $\frac{1}{44.8}$<c(HNO3)<$\frac{1}{22.4}$ |
20.1-氯丙烷与NaOH的醇溶液共热的反应,属于( )
| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 氧化反应 |
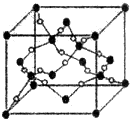 A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.
A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.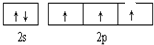 ,与AC3分子互为等电子体的阳离子为H3O+;
,与AC3分子互为等电子体的阳离子为H3O+;