题目内容
甲、乙、丙、丁、戊为五种短周期元素,且原子序数依次增大.甲与丁、丙与戊分别同主族,戊的原子最外层电子数比次外层少2个.甲与乙可以按照原子个数比3:1形成化合物A,且每个A分子中含有10个电子.请回答:
(1)戊的原子结构示意图是______,乙单质分子的电子式是______.
(2)A溶于水所得溶液呈碱性的原因是(用电离方程式表示)______.
(3)甲与丁可形成一种离子化合物,该化合物与H2O反应得到强碱溶液和H2,则该反应中,氧化剂与还原剂的物质的量之比是______.
(4)X、Y、Z为三种强电解质,分别由上述五种元素中的三种组成.X、Y、Z的稀溶液之间存在如下转化关系:
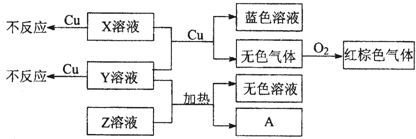
①Y、Z混合后加热得到A离子方程式是______;
②金属Cu与X、Y的混合溶液反应的离子方程式是______.
(1)戊的原子结构示意图是______,乙单质分子的电子式是______.
(2)A溶于水所得溶液呈碱性的原因是(用电离方程式表示)______.
(3)甲与丁可形成一种离子化合物,该化合物与H2O反应得到强碱溶液和H2,则该反应中,氧化剂与还原剂的物质的量之比是______.
(4)X、Y、Z为三种强电解质,分别由上述五种元素中的三种组成.X、Y、Z的稀溶液之间存在如下转化关系:

①Y、Z混合后加热得到A离子方程式是______;
②金属Cu与X、Y的混合溶液反应的离子方程式是______.
戊的原子最外层电子数比次外层少2个,应为S元素,丙与戊,则丙为O元素,甲与乙可以按照原子个数比3:1形成化合物A,且每个A分子中含有10个电子,应为NH3,则甲为H元素,乙为N元素,甲与丁,根据原子序数关系可知丁为Na元素,
(1)由以上分子可知戊为S,原子核外有3个电子层,最外层电子数为3,则原子结构示意图为 ,乙单质为N2,电子式为
,乙单质为N2,电子式为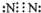 ,
,
故答案为: ;
;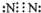 ;
;
(2)氨气水溶液中存在NH3?H2O,为弱电解质,可电离出OH-,溶液呈碱性,离子方程式为NH3?H2O?NH4++OH-,
故答案为:NH3?H2O?NH4++OH-;
(3)甲与丁可形成一种离子化合物为NaH,与水反应的方程式为NaH+H2O=NaOH+H2↑,该反应中,氧化剂是H2O与还原剂是NaH,由方程式可知二者物质的量之比是1:1,故答案为:1:1;
(4)Y溶液与Z溶液加热生成NH3,则Y溶液与Z溶液为铵盐与碱.X溶液、Y溶液单独与铜不反应,二者混合能与铜反应生成无色气体,该气体与氧气反应呈红棕色,所以红棕色气体为NO2,无色气体为NO,所以X溶液、Y溶液为硝酸盐与酸,由于Y溶液与Z溶液为铵盐与碱,所以Y为硝酸铵,Z为氢氧化钠,X为硫酸.
①Y为硝酸铵溶液,Z为NaOH溶液,二者在加热条件下可反应氨气,
反应的离子方程式为NH4++OH-
NH3↑+H2O,
故答案为:NH4++OH-
NH3↑+H2O;
②Cu与X、Y的混合溶液反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(1)由以上分子可知戊为S,原子核外有3个电子层,最外层电子数为3,则原子结构示意图为
 ,乙单质为N2,电子式为
,乙单质为N2,电子式为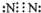 ,
,故答案为:
 ;
;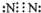 ;
;(2)氨气水溶液中存在NH3?H2O,为弱电解质,可电离出OH-,溶液呈碱性,离子方程式为NH3?H2O?NH4++OH-,
故答案为:NH3?H2O?NH4++OH-;
(3)甲与丁可形成一种离子化合物为NaH,与水反应的方程式为NaH+H2O=NaOH+H2↑,该反应中,氧化剂是H2O与还原剂是NaH,由方程式可知二者物质的量之比是1:1,故答案为:1:1;
(4)Y溶液与Z溶液加热生成NH3,则Y溶液与Z溶液为铵盐与碱.X溶液、Y溶液单独与铜不反应,二者混合能与铜反应生成无色气体,该气体与氧气反应呈红棕色,所以红棕色气体为NO2,无色气体为NO,所以X溶液、Y溶液为硝酸盐与酸,由于Y溶液与Z溶液为铵盐与碱,所以Y为硝酸铵,Z为氢氧化钠,X为硫酸.
①Y为硝酸铵溶液,Z为NaOH溶液,二者在加热条件下可反应氨气,
反应的离子方程式为NH4++OH-
| ||
故答案为:NH4++OH-
| ||
②Cu与X、Y的混合溶液反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.

练习册系列答案
相关题目