题目内容
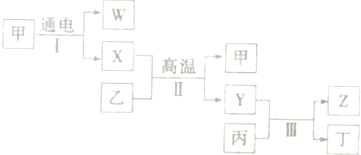
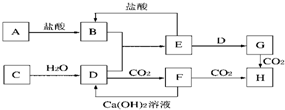
如图表示的反应关系中,部分产物被略去.已知2mol白色固体粉末X受热分解,恢复到室温生成白色固体A,无色液体B,无色气体C各1mol.X.E.G的焰色反应均为黄色.

回答下列问题:
(1)写出下列物质的化学式:A.______
(2)写出X受热的化学反应方程式:______
(3)写出X+E→A的离子方程式:______
(4)写出C与Na2O2参加反应的化学方程式______,若0.2molNa2O2参加反应,则转移的电子数为______个.

回答下列问题:
(1)写出下列物质的化学式:A.______
(2)写出X受热的化学反应方程式:______
(3)写出X+E→A的离子方程式:______
(4)写出C与Na2O2参加反应的化学方程式______,若0.2molNa2O2参加反应,则转移的电子数为______个.
X、E、G的焰色反应均为黄色,都含有Na元素;
X分解生成无色液体B,故B为H2O,B
E
G,可知E为NaOH,G为NaAlO2;
无色气体C与Na2O2反应生成白色固体A,C为CO2,A是Na2CO3,2mol白色固体粉末X受热分解,生成白色固体1molNa2CO3,1molH2O,1molCO2,根据元素守恒可知,X为NaHCO3,与NaOH反应生成Na2CO3,Na2CO3
CO2,CO2+NaAlO2→D,D为Al(OH)3,符合转化关系,NaHCO3+F→CO2,F可以是酸或铝盐等,
(1)由上述分析可知,A为Na2CO3;
故答案为:Na2CO3;
(2)NaHCO3受热分解生成碳酸钠、二氧化碳、水,反应方程式为:2NaHCO3
Na2CO3+CO2↑+H2O;
故答案为:2NaHCO3
Na2CO3+CO2↑+H2O;
(3)X+E→A是NaHCO3与NaOH反应生成Na2CO3、H2O,反应离子方程式为:HCO3-+OH-=CO32-+H2O;
故答案为:HCO3-+OH-=CO32-+H2O;
(4)C为CO2,与Na2O2反应为2Na2O2+2CO2=2Na2CO3+O2,反应中O元素化合价由-1价降低为-2价,由-1升高为0价,Na2O2既是氧化剂又是还原剂,各占
,0.2molNa2O2完全反应转移电子物质的量为0.2mol×
×2=0.2mol,转移电子数目为:0.2mol×NAmol-1=0.2NA;
故答案为:2Na2O2+2CO2=2Na2CO3+O2,0.2NA.
X分解生成无色液体B,故B为H2O,B
| Na2O2 |
| Al |
无色气体C与Na2O2反应生成白色固体A,C为CO2,A是Na2CO3,2mol白色固体粉末X受热分解,生成白色固体1molNa2CO3,1molH2O,1molCO2,根据元素守恒可知,X为NaHCO3,与NaOH反应生成Na2CO3,Na2CO3
| 足量盐酸 |
(1)由上述分析可知,A为Na2CO3;
故答案为:Na2CO3;
(2)NaHCO3受热分解生成碳酸钠、二氧化碳、水,反应方程式为:2NaHCO3
| ||
故答案为:2NaHCO3
| ||
(3)X+E→A是NaHCO3与NaOH反应生成Na2CO3、H2O,反应离子方程式为:HCO3-+OH-=CO32-+H2O;
故答案为:HCO3-+OH-=CO32-+H2O;
(4)C为CO2,与Na2O2反应为2Na2O2+2CO2=2Na2CO3+O2,反应中O元素化合价由-1价降低为-2价,由-1升高为0价,Na2O2既是氧化剂又是还原剂,各占
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:2Na2O2+2CO2=2Na2CO3+O2,0.2NA.

练习册系列答案
相关题目