题目内容
【题目】下列对化学平衡移动的分析中,不正确的是
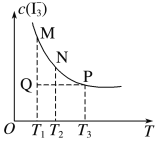
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④B.①②③C.②③④D.①②③④
【答案】D
【解析】
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),若增加C(s)物质的量,则平衡不移动,①不正确;
CO(g)+H2(g),若增加C(s)物质的量,则平衡不移动,①不正确;
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率降低,②不合题意;
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率降低,②不合题意;
③有气体参加的反应达到平衡时,减小反应器容积,相当于加压,平衡向气体分子数减小的方向移动,③不正确;
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,混合气的体积增大,反应物和生成物浓度同等程度减小,相当于减小压强,平衡向气体分子数增大的方向移动,④不正确。
综合以上分析,①②③④都不正确。
故选D。

 寒假学与练系列答案
寒假学与练系列答案【题目】碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用。
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是______________(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为____________。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的化学方程式为_____________。
(3)某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,,关闭活塞a。

① B中反应的离子方程式是________。
②通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.挥发性 B. 还原性 C. 氧化性 D. 酸性
③ C装置中的试剂X是________(写化学式)。D中反应的化学方程式是________。
④碳、硅的非金属性逐渐减弱的原因:碳和硅______。