题目内容
【题目】碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用。
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是______________(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
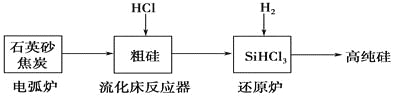
①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为____________。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的化学方程式为_____________。
(3)某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,,关闭活塞a。
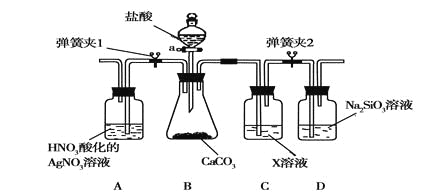
① B中反应的离子方程式是________。
②通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.挥发性 B. 还原性 C. 氧化性 D. 酸性
③ C装置中的试剂X是________(写化学式)。D中反应的化学方程式是________。
④碳、硅的非金属性逐渐减弱的原因:碳和硅______。
【答案】SiO2+2NaOH===Na2SiO3+H2O D SiO2+3C![]() SiC+2CO↑ 精馏(或蒸馏) SiHCl3+4H2O(或3H2O) = H4SiO4(或H2SiO3) +H2↑+3HCl↑ CaCO3+ 2H+= Ca2++ CO2↑+ H2O A D NaHCO3 Na2SiO3+ CO2+ H2O = H2SiO3(胶体)+ Na2CO3 位于同一主族,从上到下,原子半径逐渐增大,得电子能力减弱,非金属性减弱。
SiC+2CO↑ 精馏(或蒸馏) SiHCl3+4H2O(或3H2O) = H4SiO4(或H2SiO3) +H2↑+3HCl↑ CaCO3+ 2H+= Ca2++ CO2↑+ H2O A D NaHCO3 Na2SiO3+ CO2+ H2O = H2SiO3(胶体)+ Na2CO3 位于同一主族,从上到下,原子半径逐渐增大,得电子能力减弱,非金属性减弱。
【解析】
(1)玻璃中的二氧化硅和氢氧化钠溶液反应生成硅酸钠是矿物胶能把瓶口和瓶塞粘结在一起,纯碱为碳酸钠熔融时不能创造和碳酸钠反应的物质,如玻璃、石英玻璃中的二氧化硅,氧化铝是两性氧化物和碱发生反应;
(2)①石英砂主要成分为二氧化硅,二氧化硅和碳在高温的条件下反应生成碳化硅和一氧化碳;
②根据题中数据,采用精馏(或蒸馏)方法提纯SiHCl3;
③SiHCl3水解生成硅酸、氢气和氯化氢;
④根据同一主族性质递变规律分析解答。
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是玻璃中的二氧化硅和氢氧化钠溶液反应生成硅酸钠是矿物胶能把瓶口和瓶塞粘结在一起,发生反应的化学方程式为:SiO2+2NaOH═Na2SiO3+H2O,需要用橡胶塞,Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是铁坩埚,玻璃、石英玻璃中的二氧化硅,氧化铝是两性氧化物,都和碱发生反应,不能选择ABC,
故答案为:SiO2+2NaOH═Na2SiO3+H2O;D;
(2)①石英砂的主要成分是二氧化硅,在反应中生成碳化硅,反应为:SiO2+3C![]() SiC+2CO↑,
SiC+2CO↑,
故答案为:SiO2+3C![]() SiC+2CO↑;
SiC+2CO↑;
②利用沸点的不同提纯SiHCl3属于蒸馏,SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),由于沸点差别较大,可以通过精馏(或蒸馏)除去杂质,
故答案为:精馏(或蒸馏);
③SiHCl3水解反应方程式为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑,故答案为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑;
④由于碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱,所以碳、硅的非金属性逐渐减弱。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】一定温度时,向2.0L恒容密闭容器中充入2molSO2和1mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前2s的平均速率v(O2)=0.2mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.相同温度下,起始时向容器中充入4molSO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变向该容器中再充入2molSO2、1molO2,反应达到新平衡时![]() 增大
增大


