题目内容
【题目】(1)3mol甲烷燃烧时,生成液态水和二氧化碳,同时放出2670.9kJ的热量,写出该反应的热化学方程式___。
(2)当1g氨气完全分解为N2和H2时,吸收2.7kJ的热量,写出其热化学方程式:___。
(3)HCl和NaOH反应的中和热ΔH= -57.3kJ/mol,则H2SO4和NaOH反应的中和热的热化学方程式:___。
(4)2g H2完全燃烧生成液态水,放出285.8kJ热量,写出该反应的热化学方程式:___。
【答案】3CH4(g)+6O2(g)=6H2O(g)+3CO2(g) ΔH= -2670.9kJ/mol 2NH3(g)![]() N2(g)+3H2(g) ΔH= +91.8kJ/mol
N2(g)+3H2(g) ΔH= +91.8kJ/mol ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH= -57.3kJ/mol H2(g)+
Na2SO4(aq)+H2O(l) ΔH= -57.3kJ/mol H2(g)+![]() O2(g)=H2O(l) ΔH= -285.8kJ/mol
O2(g)=H2O(l) ΔH= -285.8kJ/mol
【解析】
(1)根据题意写出热化学方程式即可;
(2)根据题意写出热化学方程式即可,注意数值上的对应关系;
(3)根据题意写出热化学方程式即可,注意中和热对应的是1mol的水;
(4)根据题意写出热化学方程式即可。
(1)CH4燃烧的方程式为CH4+2O2![]() 2H2O+CO2,则3mol CH4燃烧的热化学方程式为3CH4(g)+6O2(g)=6H2O(g)+3CO2(g) ΔH= -2670.9kJ/mol;
2H2O+CO2,则3mol CH4燃烧的热化学方程式为3CH4(g)+6O2(g)=6H2O(g)+3CO2(g) ΔH= -2670.9kJ/mol;
(2)n(NH3)=![]() =
=![]() mol,则2mol NH3分解吸收热量:34×2.7kJ=91.8kJ,故该反应的热化学方程式为2NH3(g)
mol,则2mol NH3分解吸收热量:34×2.7kJ=91.8kJ,故该反应的热化学方程式为2NH3(g)![]() N2(g)+3H2(g) ΔH= +91.8kJ/mol;
N2(g)+3H2(g) ΔH= +91.8kJ/mol;
(3)H2SO4和NaOH反应的中和热的热化学方程式:![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH= -57.3kJ/mol;
Na2SO4(aq)+H2O(l) ΔH= -57.3kJ/mol;
(4)n(H2)=![]() =1mol,则该反应的热化学方程式为:H2(g)+
=1mol,则该反应的热化学方程式为:H2(g)+![]() O2(g)=H2O(l) ΔH= -285.8kJ/mol。
O2(g)=H2O(l) ΔH= -285.8kJ/mol。

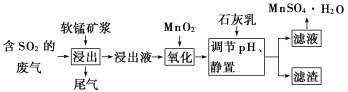
【题目】软锰矿的主要成分是二氧化锰,用软锰矿浆吸收工业废气中的二氧化硫,可以制备高纯度的硫酸锰晶体,其流程如下图所示:
已知:
①浸出液中的金属阳离子主要是![]() ,还含有少量的
,还含有少量的![]() 、
、![]() 等,且
等,且![]() .
.
②几种离子开始沉淀和完全沉淀时的pH如表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| 7.6 | 9.7 |
| 2.7 | 3.7 |
| 3.8 | 4.7 |
| 8.3 | 9.8 |
根据上述流程,回答下列问题:
(1)写出二氧化锰与二氧化硫反应的化学方程式:_____________.
(2)用离子方程式表示加入二氧化锰的作用:________________________________.
(3)从表中数据来看,________(填“能”或“不能”)取消“加入二氧化锰”的步骤,原因是________________________.
(4)下列试剂能替代二氧化锰的是________(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(5)有同学认为可以用碳酸锰![]() 或氢氧化锰
或氢氧化锰![]() 替代石灰乳,你是否同意此观点?简述理由:______________________________________________________.
替代石灰乳,你是否同意此观点?简述理由:______________________________________________________.
(6)从含硫酸锰的滤液中提取硫酸锰晶体的操作是_____________________________.