��Ŀ����
����Ŀ���Թ�ҵ��ˮ��������ˮ���д����Ƿ�ֹˮ����Ⱦ������ˮ�ʵ���Ҫ��ʩ֮һ��
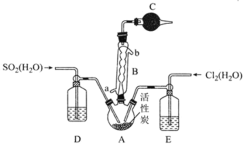
��1�����᳧�����Է�ˮ����(As)Ԫ��(��Ҫ�� H3AsO3 ��ʽ����)�������ߣ�Ϊ��������ŷţ� ij�������û�ѧ���������������ˮ����ش��������⣺
����֪���ǵ���ͬ��Ԫ�أ��ȵ�ԭ�Ӷ� 2 �����Ӳ㣬����Ԫ�����ڱ���λ��Ϊ_____��
�ڹ�ҵ�ϲ�����(ͨ��������)ȥ����ˮ�е��飬������Ϊ�����Ե������飬�÷� Ӧ�����ӷ���ʽΪ_____��
��2����Ƴ��ķ�ˮ�к��е� CN-�о綾����Ҫ���������ŷš������� CN-��ˮ�ķ���֮һ���� ����������£�CN-������������ HCO3- ��ͬʱ���� NH3���÷�Ӧ�����ӷ���ʽΪ_____��
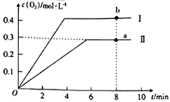
(3)������������������������Һ��ͬʱ�õ������ԭ����ͼ��ʾ(ͼ����HA����ʾ������ӣ� A�D��ʾ���������)��
�������ĵ缫��ӦʽΪ_____
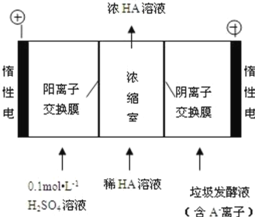
�ڵ������У���ȡһ���Ĵ�ʩ�ɿ��������ҵ� pH ԼΪ 6��8����ʱ����Ũ���ҵ� OH���ɺ��Բ� �ơ�400 mL 10 g��L��1 ������Һͨ��һ��ʱ��� Ũ������Ϊ 145 g/L(��Һ����仯���Բ���)�������ϲ����� H2 �ڱ�״���µ����ԼΪ_____L (��֪�������Ħ������Ϊ 90 g/mol)��
���𰸡��������ڢ�A�� 2H3AsO3+3S2-+6H+=As2S3��+6H2O 4H2O+2CN-+O2=2HCO3-+2NH3 4OH--4e-�T2H2O+O2����2H2O-4e-�TO2��+4H+ 6.72
��������
��1���������ǵ���ͬ��Ԫ�أ��ȵ�ԭ�Ӷ�2�����Ӳ��֪����ԭ���������5�����ӣ�4�����Ӳ㣻
�����������Ϣ��֪�����������£�������ͷ�ˮ�е����ᷴӦ�����������Ե��������ˮ��
��2���������֪��������������£�CN-������������HCO3-��ͬʱ����NH3����Ӧ��̼Ԫ�ػ��ϼ����߱���������Ԫ�ػ��ϼ�û�б仯��
��3����ˮ�������������������������ʧ���ӷ���������Ӧ�����������ƻ�ˮ�ĵ���ƽ�⣬ʹ��Һ�����ԣ�
���ɵ缫��Ӧʽ������HA�Ļ�ѧ����ʽ�ɵã�2HA��2 H+��H2���ɴ˼���ɵá�
��1���������ǵ���ͬ��Ԫ�أ��ȵ�ԭ�Ӷ�2�����Ӳ��֪����ԭ���������5�����ӣ�4�����Ӳ㣬����λ��Ԫ�����ڱ��������ڢ�A�壬�ʴ�Ϊ���������ڢ�A�壻
�����������Ϣ��֪�����������£�������ͷ�ˮ�е����ᷴӦ�����������Ե��������ˮ����Ӧ����������ԭ��������������������Ӧ�����ӷ���ʽΪ2H3AsO3+3S2-+6H+=As2S3��+6H2O���ʴ�Ϊ��2H3AsO3+3S2-+6H+=As2S3��+6H2O��
��2���������֪��������������£�CN-������������HCO3-��ͬʱ����NH3����Ӧ��̼Ԫ�ػ��ϼ����߱���������Ԫ�ػ��ϼ�û�б仯����Ӧ�����ӷ���ʽΪ4H2O+2CN-+O2=2HCO3-+2NH3���ʴ�Ϊ��4H2O+2CN-+O2=2HCO3-+2NH3��
��3����ˮ�������������������������ʧ���ӷ���������Ӧ�����������ƻ�ˮ�ĵ���ƽ�⣬ʹ��Һ�����ԣ���Һ��������Ũ�����缫��ӦʽΪ4OH-��2H2O-4e-�TO2��+4H+���ʴ�Ϊ��4OH--4e-�T2H2O+O2����2H2O-4e-�TO2��+4H+��
���ɵ缫��Ӧʽ������HA�Ļ�ѧ����ʽ�ɵã�2HA��2 H+��H2��������������HA������Ϊ��145 g/L��0.4L��10 g/L��0.4L��=54g������HA�������Ĺ�ϵʽ��֪�����ϲ����� H2 �ڱ�״���µ����ԼΪ![]() ��
��![]() ��22.4L/mol=6.72L���ʴ�Ϊ��6.72��
��22.4L/mol=6.72L���ʴ�Ϊ��6.72��

 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�����Ŀ����ұ���������ķ���������Ϊԭ����ȡ��ϸ���������������ܽ��ͻ�����Ⱦ�ֿ��������Դ�������ʡ���֪���ҵ���Ҫ�ɷ�ΪA12O3������������SiO2��FeO��Fe2O3�������Ʊ��������£�

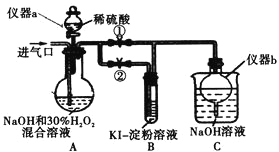
��1������ͼ������������NaOH�����Ʊ������ƣ��ɲ��õ�װ��Ϊ_____����ѡ���ţ���

��2�������м���H2O2�����������ԭ����___________________________________��
��3��ͨ��������Һ��pH�������������õ�Fe��OH��3����֪��
��Fe3+ | ��Fe2+ | ��Al3+ | |
����ʼ����ʱ��pH | ��2.2 | ��7.5 | ��3.7 |
����ȫ����ʱ��pH | ��3.2 | ��9.0 | ��4.7 |
Ϊ��֤��Ʒ�Ĵ��ȣ�����ѡ�����������е�_______������ҺpH������ĸ��������pH�ķ�ΧΪ______________��
a��Al2O3 b��NaOH c��Al��OH��3 d��Na2CO3
��4������������茶��壬��������Ҫ��ӦΪ��4[NH4Al��SO4��212H2O]![]() 2Al2O3+2NH3��+N2��+5SO3��+3SO2��+53H2O��������������ͨ����ͼ��ʾ��װ�ã�
2Al2O3+2NH3��+N2��+5SO3��+3SO2��+53H2O��������������ͨ����ͼ��ʾ��װ�ã�

�ټ���ƿ���ռ�����������____________���ѧʽ����
��װ��KMnO4��Һϴ��ƿ��������____________________________��
��ѡ��һ�ֳ��û�ѧ�Լ���ϡ�������������泥����Լ�_________��д��������識����������Լ������ӷ���ʽ__________________________________________________��
��20��ʱ��0.1mol��L��1������泥�����ҺpH=3,����Һ�У�2c(SO42��)��c(NH4+)��3c(Al3+)=____________mol��L��1����������ּ���ʽ�����ػ���