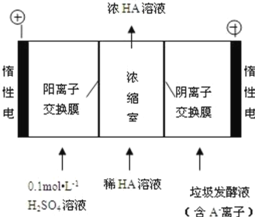
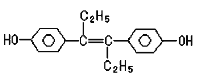
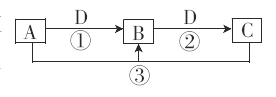
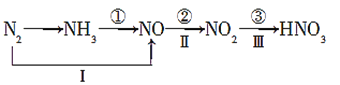题目内容
【题目】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图所示。

已知:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃。
请回答:
(1)仪器A的名称为________;仪器B的作用是________;冰水浴冷却的目的是____________(写出两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因______________。
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①_______________________________(用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+。
【答案】三颈烧瓶 防止倒吸 减少H2O2的分解、降低NaClO2的溶解度、增加ClO2的溶解度(任写两种) 空气流速过慢时,ClO2不能及时被气流带走,浓度过高导致分解,空气流速过快时,ClO2不能被充分吸收 2ClO3-+4H++2Cl-=2ClO2↑+2H2O+Cl2↑
【解析】
根据题中过氧化氢法制备NaClO2固体的实验装置可知,本题考查制备实验方案的设计,氯、溴、碘及其化合物的综合应用,运用氯、溴、碘及其化合物的性质进行分析。
(1)仪器A为三颈烧瓶,仪器B的作用是防止倒吸;冰水浴冷却的目的是为降低NaClO2的溶解度;减少H2O2的分解;增加ClO2的溶解度;
故答案为:三颈烧瓶 防止倒吸 减少H2O2的分解、降低NaClO2的溶解度、增加ClO2的溶解度(任写两种)
(2)空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;空气流速过快时,ClO2不能被充分吸收,则空气流速过快或过慢,均降低NaClO2产率;
故答案为:空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;空气流速过快时,ClO2不能被充分吸收;
(3)Clˉ存在时会催化ClO2的生成,反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气反应为2ClO3-+4H++2Cl-=2ClO2↑+2H2O+Cl2↑,H2O2+Cl2=2Cl-+O2+2H+
故答案为:2ClO3-+4H++2Cl-=2ClO2↑+2H2O+Cl2↑