题目内容
【题目】以冶炼金属铝的废弃物铝灰为原料制取超细α-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:

(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为_____(填选项编号)。

(2)流程中加入H2O2有气体产生,原因是___________________________________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.已知:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 3.7 |
完全沉淀时的pH | 3.2 | 9.0 | 4.7 |
为保证产品的纯度,可以选用下列物质中的_______调节溶液pH(填字母),调节pH的范围为______________。
a.Al2O3 b.NaOH c.Al(OH)3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)212H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:

①集气瓶中收集到的气体是____________(填化学式)。
②装有KMnO4溶液洗气瓶的作用是____________________________。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂_________。写出硫酸铝铵加入足量该试剂的离子方程式__________________________________________________。
④20℃时,0.1mol·L-1硫酸铝铵,其溶液pH=3,则溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=____________mol·L-1(填具体数字计算式,不必化简)
【答案】B Fe3+对H2O2的分解有催化作用 ac 3.2≤pH<3.7 N2 吸收SO2 Ba(OH)2 NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3+3H2O 10-3-10-11
【解析】
(1)铝灰中A12O3、FeO、Fe2O3均被稀硫酸溶解,所以剩余的“滤渣”的主要成分是SiO2;二氧化硅与氢氧化钠焙烧制备硅酸钠;蒸发皿不能用来加热固体;铁与二氧化硅、氢氧化钠均不反应,可以用铁坩埚进行加热;玻璃中含二氧化硅和氢氧化钠反应;瓷坩埚含有二氧化硅和氢氧化钠反应;
(2)双氧水在氧化亚铁离子时,溶液中的Fe3+对H2O2的分解有催化作用,所以流程中加入H2O2有气体产生;
(3)本流程最终制备氧化铝,因此,要加入含有铝元素,能够与酸反应,但不溶于水的化合物来调节溶液的pH,氧化铝、氢氧化铝都不溶于水,都能和酸反应,溶解后又不产生新杂质,满足流程要求;而氢氧化钠、碳酸钠不仅和铁离子反应,也能和铝离子反应,无法达到只沉铁的目的;
为了使铁离子变为沉淀,而铝离子不沉淀,根据表中数据可知,调节溶液的pH的范围为3.2≤pH<3.7;
(4)将产生的混合气体通入装置中,水分溶在NaHSO3溶液中,SO3溶于水生成H2SO4,H2SO4与NaHSO3反应生成SO2;同时NaHSO3溶液能与氨水反应,所以混合气体中被吸收了SO3和NH3;KMnO4具有强氧化性,能将SO2氧化,最终用排水法收集N2。
①NH4Al(SO4)212H2O分解生成的气体NH3和SO3被亚硫酸钠吸收,二氧化硫被高锰酸钾吸收,所以最后集气瓶中收集到的气体是N2;
②KMnO4具有强氧化性,能将SO2氧化吸收;因此装有KMnO4溶液洗气瓶的作用是吸收SO2;
③NH4Al(SO4)212H2O晶体中含有铵根离子、铝离子和硫酸根离子,加入浓Ba(OH)2溶液就可以检验出三种离子;硫酸铝铵加入足量Ba(OH)2溶液反应生成硫酸钡、偏铝酸钡、一水合氨,据此写出离子方程式;
④20℃ 时,0.1mol·L-1硫酸铝铵,其溶液pH=3,根据电荷守恒分析离子浓度的关系。
(1)能够焙烧固体的装置是坩埚,NaOH能和二氧化硅反应生成硅酸钠,所以不能采用瓷坩埚灼烧,所以应该采用铁坩埚,故选B,
故答案为:B;
(2)在实验流程中,H2O2具有氧化性,能氧化亚铁离子生成铁离子,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,而Fe3+对H2O2的分解有催化作用。
故答案为:Fe3+对H2O2的分解有催化作用;
(3)为保证产品-氧化铝的纯度,可以选用a.A12O3 c.Al(OH)3调节溶液pH。Fe3+开始沉淀的pH=2.2,沉淀完全的pH=3.2要使Fe3+完全沉淀调节pH的范围为3.2≤pH<3.7。
故答案为:a c; 3.2≤pH<3.7;
(4)①依据方程式:4[NH4Al(SO4)212H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,煅烧硫酸铝铵晶体,生成的气体有NH3、N2、SO3、SO2、H2O,混合气体中氨气、三氧化硫易溶于水,能够被饱和NaHSO3溶液吸收,二氧化硫具有还原性能够被酸性高锰酸钾溶液吸收,氮气不溶于水,不能被吸收,剩余N2,所以集气瓶中收集到的气体是N2;
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,煅烧硫酸铝铵晶体,生成的气体有NH3、N2、SO3、SO2、H2O,混合气体中氨气、三氧化硫易溶于水,能够被饱和NaHSO3溶液吸收,二氧化硫具有还原性能够被酸性高锰酸钾溶液吸收,氮气不溶于水,不能被吸收,剩余N2,所以集气瓶中收集到的气体是N2;
故答案为:N2;
②二氧化硫能够与酸性高锰酸钾发生氧化还原反应,所以装有KMnO4溶液洗气瓶的作用是吸收SO2;
故答案为:吸收SO2;
③NH4Al(SO4)212H2O晶体中含有铵根离子、铝离子和硫酸根离子,加入浓Ba(OH)2溶液就可以检验出三种离子:向硫酸铝铵溶液中逐滴浓氢氧化钡溶液直至过量,先产生白色沉淀,并闻到有刺激性气味;因为硫酸钡不溶于强碱,而氢氧化铝溶于过量的强碱;所以当碱过量后,白色沉淀部分溶解;
硫酸铝铵加入足量Ba(OH)2溶液反应生成硫酸钡、偏铝酸钡、一水合氨;离子方程式NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3+3H2O;
故答案为:Ba(OH)2;NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3+3H2O;
④20℃ 时,0.1mol·L-1硫酸铝铵,其溶液pH=3,根据电荷守恒,有2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)= c(H+)-![]() =(10-3-10-11)molL-1,
=(10-3-10-11)molL-1,
故答案为:10-3-10-11。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】实验室制备硝基苯的方法是将苯与浓硫酸和浓硝酸的混合液加热到 50~60℃反应。已知苯与硝基苯的基本物理性质如下表所示:
熔点 | 沸点 | 状态 | |
苯 | 5.51℃ | 80.1℃ | 无色液体 |
硝基苯 | 5.7℃ | 210.9℃ | 油状液体 |
(1)(在大试管中)配制浓硫酸和浓硝酸的混合酸的操作方法是____________________。
(2)分离硝基苯和水的混合物的方法是________;分离硝基苯和苯的方法是_________。
(3)某同学用如图装置制取硝基苯:
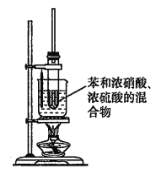
①用水浴加热的优点是________________________________________________________;
②被水浴加热的试管口部都要带一长导管,其作用是______________________________。
(4)写出此反应的化学方程式_________________________________________________。





