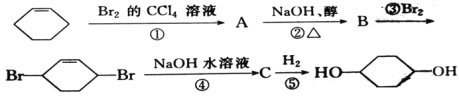
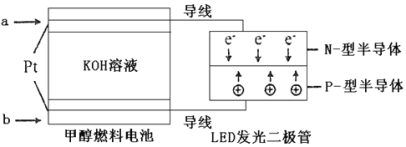
题目内容
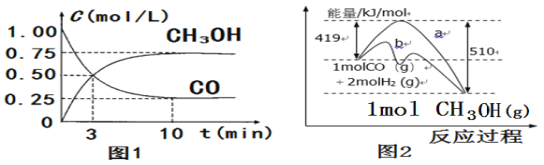
【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行
【答案】AC
【解析】
先分析反应:CO(g)+2H2(g) ![]() CH3OH(g),气体分子数两边不等;再对比容器Ⅰ、Ⅱ,体积相等,均从反应物开始,Ⅱ中H2浓度是Ⅰ中H2的一半,平衡后Ⅱ中H2浓度也是Ⅰ中H2的一半,如果a=1, 则Ⅰ相当于在与Ⅱ等效的基础上加压,平衡偏向正向,平衡时H2的物质的量浓度小于1molL-1,所以a应小于1。根据Ⅱ的平衡可计算出T1时的平衡常数:
CH3OH(g),气体分子数两边不等;再对比容器Ⅰ、Ⅱ,体积相等,均从反应物开始,Ⅱ中H2浓度是Ⅰ中H2的一半,平衡后Ⅱ中H2浓度也是Ⅰ中H2的一半,如果a=1, 则Ⅰ相当于在与Ⅱ等效的基础上加压,平衡偏向正向,平衡时H2的物质的量浓度小于1molL-1,所以a应小于1。根据Ⅱ的平衡可计算出T1时的平衡常数:
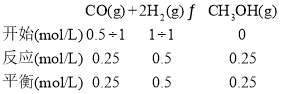
![]()
可在此基础上对各选项作出判断。
A. 0~5 min时,容器Ⅰ中v(CO)=![]() v(H2)=
v(H2)= ![]() ×
×![]() =0.1 mol·L-1·min-1,A选项正确;
=0.1 mol·L-1·min-1,A选项正确;
B. 如果a=1,则Ⅰ相当于在与Ⅱ等效的基础上加压,使得平衡时H2的物质的量浓度小于1molL-1,B选项错误;
C. 容器Ⅱ温度改变为T2(T2>T1)时,平衡常数KT2=1<KT1=4,说明升高温度反应逆向移动,则ΔH<0,C选项正确;
D. T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,此时Q=![]() =1<KT1=4,反应将向正反应方向进行,D选项错误;
=1<KT1=4,反应将向正反应方向进行,D选项错误;
答案选AC。

【题目】氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。
(1)写出实验室制取氨气的化学方程式_____。
(2)工业上合成氨的反应N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
过程中能量变化如图所示。
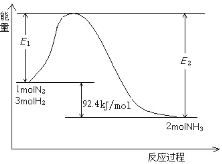
①该反应是_____反应。(填“放热”或“吸热”)
②在反应体系中加入催化剂,E2会_____。(填“增大”或“减小”或“不变”)
③若要增大NH3产率,可采取的措施有_____。(填字母)
a.升高温度 b.增大压强 c.不断分离出NH3
(3)利用如图所示装置探究NH3能否被NO2氧化。
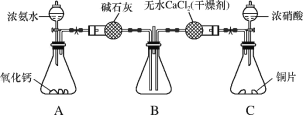
①C装置中制取NO2反应的离子方程式是_____。
②某同学认为NH3能被NO2氧化,且全部生成无毒物质,预期观察到B装置中红棕色消失。下表为不同时间下观察到的现象。
时间 | 1分钟 | 2分钟 | 3分钟 |
现象 | 红棕色未消失 | 红棕色未消失 | 红棕色未消失 |
请分析没有达到预期现象可能的原因(任写两条)_____、_____。