题目内容
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于纸浆漂白、水处理等;工业上生产NaClO2有多种方法,某工业生产的流程如图所示:
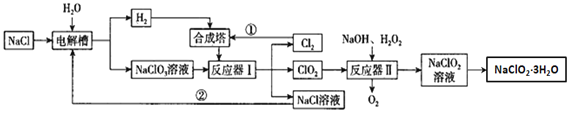
请回答下列问题:
(1)合成塔中生成的物质是___(填化学式);
(2)电解槽中阳极上的电极反应式为___;
(3)反应器Ⅰ中发生反应的化学方程式为___;反应器Ⅱ中发生的反应中氧化剂与还原剂物质的量之比为___;
(4)流程中①、②在工业生产中的现实意义是___;
(5)从NaClO2溶液中得到NaClO2·3H2O粗晶体的步骤为___、___,过滤、洗涤干燥;
(6)为了测定NaClO2·3H2O的纯度,取上述合成产品10g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.264mol/LNa2S2O3标准液滴定,锥形瓶中溶液___(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.00mL,试样纯度是否合格___(填“合格”或“不合格”,合格纯度在90%以上)。提示:2Na2S2O3+I2=Na2S4O6+2NaI。
【答案】HCl Cl-+3H2O-6e-=ClO3-+6H+ 2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O 2:1 循环利用,提高原料利用率,降低生产成本 蒸发浓缩 冷却结晶 蓝色变为无色 合格
【解析】
NaCl溶液在电解槽中电解,生成氢气和NaClO3溶液,氢气和氯气在合成塔中化合成氯化氢。NaClO3溶液在反应器Ⅰ中和HCl发生反应生成氯气、二氧化氯和NaCl,NaCl和氯气可以循环使用。二氧化氯和NaOH以及过氧化氢在反应器Ⅱ中发生反应生成NaClO2。因为要从亚氯酸钠溶液中获取亚氯酸钠晶体,所以采取蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
![]() 根据流程图可知,合成塔为氢气与氯气反应,生成HCl;故答案为:HCl;
根据流程图可知,合成塔为氢气与氯气反应,生成HCl;故答案为:HCl;
![]() 根据题意电解NaCl溶液得到氢气和
根据题意电解NaCl溶液得到氢气和![]() 溶液,阳极发生氧化反应,元素化合价升高,故阳极得到
溶液,阳极发生氧化反应,元素化合价升高,故阳极得到![]() 溶液,电极反应式为:
溶液,电极反应式为:![]() ;故答案为:
;故答案为:![]() ;
;
![]() 反应器Ⅰ中发生反应为HCl与
反应器Ⅰ中发生反应为HCl与![]() 溶液反应得到氯气、
溶液反应得到氯气、![]() 和NaCl,故反应为:
和NaCl,故反应为:![]() ;
;![]() 和NaOH、
和NaOH、![]() 在反应器II发生反应:
在反应器II发生反应:![]() ,氯元素化合价降低被还原,
,氯元素化合价降低被还原,![]() 为氧化剂,
为氧化剂,![]() 为还原剂,故氧化剂与还原剂物质的量之比为2:1;故答案为:
为还原剂,故氧化剂与还原剂物质的量之比为2:1;故答案为:![]() ;2:1;
;2:1;
![]() 流程中①、②是将得到的氯气和NaCl溶液循环利用,提高原料利用率,降低生产成本;故答案为:循环利用,提高原料利用率,降低生产成本;
流程中①、②是将得到的氯气和NaCl溶液循环利用,提高原料利用率,降低生产成本;故答案为:循环利用,提高原料利用率,降低生产成本;
![]() 从
从![]() 溶液中得到
溶液中得到![]() 粗晶体的步骤为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;故答案为:蒸发浓缩;冷却结晶;
粗晶体的步骤为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;故答案为:蒸发浓缩;冷却结晶;
![]() 取上述合成产品10g溶于水配成500mL溶液,取出10
取上述合成产品10g溶于水配成500mL溶液,取出10![]() 将KI氧化为碘单质,反应为:
将KI氧化为碘单质,反应为:![]() ,充分反应后加入
,充分反应后加入![]() 滴淀粉溶液,溶液显蓝色,用
滴淀粉溶液,溶液显蓝色,用![]()
![]() 标准液滴定,当碘反应完成,达到滴定终点,观察到溶液蓝色变为无色,且半分钟内不发生变化,根据关系式:
标准液滴定,当碘反应完成,达到滴定终点,观察到溶液蓝色变为无色,且半分钟内不发生变化,根据关系式:![]() ,则
,则![]() ,所以500mL溶液中含有:
,所以500mL溶液中含有:![]() ,则10g合成产品中含有:
,则10g合成产品中含有:![]() ,则
,则![]() ,所以产品合格;故答案为:蓝色变为无色;合格。
,所以产品合格;故答案为:蓝色变为无色;合格。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案