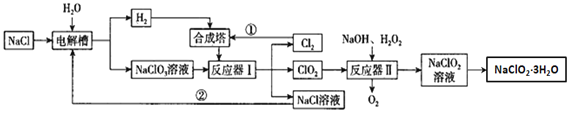
题目内容
【题目】下列判断正确的是
A.Na2S2O3溶液中加入稀硫酸的离子方程式为:2S2O32-+4H+![]() SO42-+ 3S↓+ 2H2O
SO42-+ 3S↓+ 2H2O
B.用TiCl4制备TiO2的反应可表示为:TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
C.滴加甲基橙试液后呈红色的溶液中可以大量共存: Na+、 CO32-、 K+、 AlO2-
D.25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA
【答案】B
【解析】
A.不符合电荷守恒,应为S2O32-+2H+![]() SO2↑+ S↓+H2O,A项错误;
SO2↑+ S↓+H2O,A项错误;
B.化学方程式应遵循原子守恒,该选项的化学方程式符合,B项正确;
C.滴加甲基橙试液后变红的溶液显酸性,CO32-和AlO2-均能和H+反应,不能大量共存,C项错误;
D.没有溶液的体积,不能推算该溶液中OH-的数目,D项错误;
故选B。

练习册系列答案
相关题目