题目内容
【题目】常温下,向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如下,下列说法正确的是
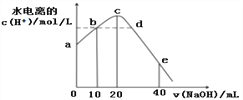
A. 从a到c,对醋酸的电离既有促进作用也有抑制作用
B. b、d两点溶液的pH相同
C. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH) = 0.01mol/L
D. 从b→d的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7的点
【答案】D
【解析】
A.醋酸溶液中存在CH3COOH![]() CH3COO-+H+,加NaOH溶液消耗氢离子,醋酸的电离平衡正移,所以从a到c,醋酸的电离始终受到促进,故A错误;B.b点醋酸过量,其电离使溶液显酸性,d点,NaOH过量,pH大于7,故B错误;C.e点所示溶液中,NaOH的物质的量是醋酸的物质的量2倍,反应后醋酸钠和NaOH 等物质的量,根据物料守恒为c(Na+)=2c(CH3COO-)+2c(CH3COOH)=0.01mol/L×
CH3COO-+H+,加NaOH溶液消耗氢离子,醋酸的电离平衡正移,所以从a到c,醋酸的电离始终受到促进,故A错误;B.b点醋酸过量,其电离使溶液显酸性,d点,NaOH过量,pH大于7,故B错误;C.e点所示溶液中,NaOH的物质的量是醋酸的物质的量2倍,反应后醋酸钠和NaOH 等物质的量,根据物料守恒为c(Na+)=2c(CH3COO-)+2c(CH3COOH)=0.01mol/L×![]() ,故C错误;D.c点,醋酸与氢氧化钠恰好反应生成醋酸钠,溶液显碱性,氢氧化钠体积小于20mL时的某一个值恰好使溶液显中性,所以从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点,故D正确;故选D。
,故C错误;D.c点,醋酸与氢氧化钠恰好反应生成醋酸钠,溶液显碱性,氢氧化钠体积小于20mL时的某一个值恰好使溶液显中性,所以从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点,故D正确;故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目