题目内容
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1) E元素在周期表中的位置 ;化合物M中含有的化学键类型有
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是
(用化学式表示);写出C与A形成的18e-化合物的电子式 ,
该化合物类型为 (填“共价化合物”或“离子化合物”)
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式
;写出题中生成M的化学方程式
(1)第三周期、第ⅣA族;离子键和极性共价键;
(2)H2O>NH3>SiH4,  ,共价化合物;
,共价化合物;
(3)SiO2+2OH-=SiO32-+H2O, NH3+HNO3=NH4NO3。
解析试题分析:根据题意知,A、B、C、D、E五种短周期元素,E的单质可做半导体材料,则E为硅元素;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,则B为氮元素,M为NH4NO3,1mol中含有42mol电子;B、D、E三种元素原子的最外层电子数之和为10,则D的最外层电子数为1,又D的原子序数最大,则D为钠元素;A、D同主族,且A的原子序数和原子半径都最小,A为氢元素;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应,应是SiO2和NaOH的反应,则C为氧元素。(1) E为硅元素,在周期表中的位置第三周期、第ⅣA族;化合物M为NH4NO3,含有的化学键类型有离子键和极性共价键;(2)B、C、E形成的气态氢化物分别为NH3、H2O、SiH4,由于非金属性O>N>Si,则氢化物稳定性为H2O>NH3>SiH4,C与A形成的化合物中,H2O2含有18个e-,其电子式为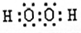 ,该化合物类型为共价化合物;(3)C与E两元素形成的化合物SiO2为酸性氧化物,与NaOH反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,生成NH4NO3的化学方程式为NH3+HNO3=NH4NO3。
,该化合物类型为共价化合物;(3)C与E两元素形成的化合物SiO2为酸性氧化物,与NaOH反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,生成NH4NO3的化学方程式为NH3+HNO3=NH4NO3。
考点:考查元素推断、元素周期律及相关物质的结构和性质,

 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案目前,医疗上使用放射性核素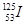 治疗肿瘤,该核素原子核内的中子数与电子数之差是
治疗肿瘤,该核素原子核内的中子数与电子数之差是
| A. 125 | B.72 | C.19 | D.53 |
、下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | ⑧ | ⑨ | |
(1)画出元素②的原子结构示意图 。
(2)属于稀有气体的元素编号是_______,可作半导体材料的元素编号是______。
(3)③、⑦两种元素相比较,非金属性强的是 (填元素符号)。
(4)元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是 , 。
(18分)运用物质结构的知识完成下列问题。
(1)第一电离能介于B、N之间的第二周期元素有 (填元素符号)。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,配体的化学式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
Q R
①晶体Q中不存在的作用力为 (填字母)。
A.共价键 B.离子键 C.配位键 D.范德华力 E.氢键
②R中阳离子的空间构型为 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm—(含B、O、H三种元素)的球棍模型如下图3所示。则m= (填数字)。
(5)以四氯化钛、碳化钙、叠氮酸盐(如NaN3)作原料,可以生成碳氮化钛化合物,其结构是用碳原子取代氮化钛晶胞(结构如下图4)所有顶点的氮原子,这种碳氮化钛化合物的化学式为 。

图3 图4
(6)部分化学键的键能见下表:
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
②工业上高纯硅可通过下列反应制取:SiCl4 (g) + 2H2(g) 高温Si(s) + 4HCl(g)
计算该反应的反应热△H =___________ kJ/mol。
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是 ,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式: 。
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
[Mn(H2O)6]2+ (填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为
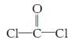 ,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是 。
(7分)决定物质性质的重要因素是物质结构。请回答下列问题:
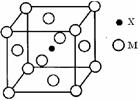
(1)铜是过渡元素。化合物中,铜常呈现+1价或+2价。右图为某铜氧化物晶体结构单元,该氧化物的化学式为 。
(2)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(3)A和B为第三周期元素,其原子的部分电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5、CrO2、Fe3O4中,更适合作录音带磁粉原料的是__________(填化学式)。
(5)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。
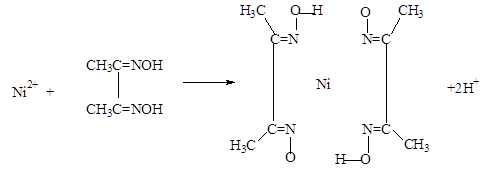
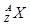 表示B原子的组成 ,
表示B原子的组成 ,