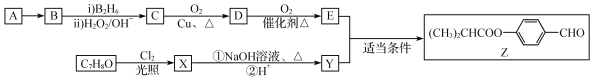
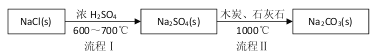
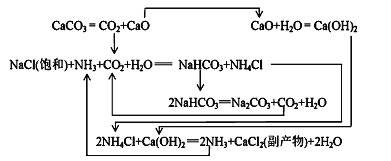
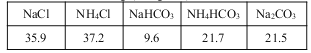
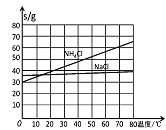
题目内容
【题目】Ⅰ、单质硅由于其成熟的生产工艺, 丰富的生产原料及优异的性能被广泛用于电子行业及太阳能电池的生产等,在二氧化碳氛围中通过利用金属钠来还原二氧化硅可在较低的温度条件下得到硅,同时生成一种盐X,这相比起现有的生产工艺具有节约能耗的优势。
(1)写出上述制备硅的化学反应方程式_____________________。
(2)二氧化硅与二氧化碳物理性质差别很大,原因是__________________________。
(3)盐X的溶液能与Al2(SO4)3溶液反应生成一种白色沉淀和气体。写出此反应的离子反应方程式________。
Ⅱ、某盐A有3种元素组成,易溶于水。将A加热,生成既不助燃,也不使湿润的红色或蓝色石蕊试纸变色的气体B和H2O。将A溶于水,进行下列实验:①酸性条件下与H2S作用生成淡黄色沉淀C,同时放出无色气体D,D在空气中转变为红棕色气体E;②当通入足量Cl2时,无明显现象,但将所得溶液浓缩后即可得到无色晶体盐F。请回答下列问题:
(1)写出A的化学式:_____________; B的电子式:_______________。
(2)写出上述实验①、②所发生的离子反应方程式:①________________________________;②__________________________________。
(3)D、E对环境有危害,可用NaOH溶液来吸收等物质的量的D、E混合气体,写出其化学反应方程式___________________。
(4)判断盐F的可能成份______________;设计实验方案确定F的成份__________________。
【答案】Ⅰ、 (1)SiO2+ 4Na + 2CO2= 2Na2CO3+ Si ;
(2)二氧化硅是原子晶体,二氧化碳是分子晶体(3)3CO32—+2Al3++3H2O= 2Al(OH)3↓+3CO2↑
Ⅱ、 (1)NH4NO2;B的电子式:![]() ;
;
(2) ①2NO2—+2H++H2S=S↓+2NO↑+2H2O;②NO2—+H2O+Cl2=NO3—+2Cl—+2H+;
(3) NO2+NO+2NaOH=2NaNO2+H2O;(4) 化合物F可能为NH4NO3或NH4Cl或NH4NO3和NH4Cl的混合物取mg F,加入足量的硝酸酸化的AgNO3溶液,若产生沉淀,则含有NH4Cl,再通过产生沉淀的质量与m之间的关系可确定是否含有NH4NO3;若无沉淀,则只有NH4NO3。
【解析】试题分析:Ⅰ.(1)在二氧化碳氛围中通过利用金属钠来还原二氧化硅可在较低的温度条件下得到硅,同时生成碳酸钠,方程式为:SiO2+ 4Na + 2CO2= 2Na2CO3+ Si;
(2)二氧化硅为原子晶体,固态,具有较高的熔沸点,硬度大,二氧化碳为分子晶体,气态,具有较低的熔沸点,因此二者的物理性质相差很大;
(3)碳酸根与铝离子能够在溶液中发生双水解,生成二氧化碳气体和氢氧化铝沉淀,离子方程式为:
3CO32—+2Al3++3H2O= 2Al(OH)3↓+3CO2↑;
Ⅱ. ①酸性条件下与H2S作用生成淡黄色沉淀C,则C为单质硫,同时放出无色气体D,D在空气中转变为红棕色气体E,则D为NO,E为NO2,说明A是亚硝酸盐;将A加热,生成既不助燃,也不使湿润的红色或蓝色石蕊试纸变色的气体B和H2O;②当通入足量Cl2时,无明显现象,但将所得溶液浓缩后即可得到无色晶体盐F ,证明为铵盐;结合A有三种元素组成,易溶于水,将A加热分解,则A为NH4NO2;加热,生成既不助燃也不能使湿润的红色或蓝色石蕊试纸变色的气体B和H2O,则B为氮气。据此回答问题。
(1)A的化学式为NH4NO2,B为N2,电子式为![]() ;
;
(2)①酸性条件下与H2S作用生成淡黄色沉淀C,则C为单质硫,同时放出无色气体D,D在空气中转变为红棕色气体E,则D为NO,反应方程式为:2NO2—+2H++H2S=S↓+2NO↑+2H2O;②NH4NO2与Cl2反应的方程式为:NO2—+ H2O +Cl2=NO3—+2 Cl—+2H+;
(3)NO和NO2对环境有危害,可用NaOH溶液来吸收等物质的量的NO和NO2混合气体,方程式为:NO2+NO+2NaOH=2NaNO2+H2O;
(4)溶液浓缩后得到无色晶体F,则F可能为NH4NO3或NH4Cl或NH4NO3和NH4Cl的混合物;可设计实验确定F的成分:取mg F,加入足量的硝酸酸化的AgNO3溶液,若产生沉淀,则含有NH4Cl,再通过产生沉淀的质量与m之间的关系可确定是否含有NH4NO3;若无沉淀,则只有NH4NO3。