题目内容
【题目】铝热法炼铬废渣主要成分为Al2O3和Cr2O3,还含有MgO、FeO、Fe2O3等杂质,以下是以炼铬废渣为原料回收Al2O3和Cr2O3的流程图:

已知:
①“焙烧”涉及的主要反应:Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
Cr2O3+Na2CO3+O2![]() Na2CrO4+CO2↑(未配平);
Na2CrO4+CO2↑(未配平);
②滤液2中涉及的反应:8CrO42--+3S2O32-+34H+===6SO42-+8Cr3++17H2O
③Ksp[Cr(OH)3]=8×10-32
根据题意回答下列问题:
(1)请完成下列化学方程式的配平:
Cr2O3+ Na2CO3+ O2 ![]() Na2CrO4+ CO2↑;
Na2CrO4+ CO2↑;
(2)炼铬废渣在焙烧前需球磨粉碎,其目的是 。
(3)滤渣1的主要成分是 。
(4)流程中可以循环利用的物质是 。
(5)写出步骤Ⅲ“碳分”的离子反应方程式: 。
(6)滤液2还原后的溶液中为使Cr3+沉淀完全,溶液pH应小于 。(已知:lg5=0.7;当溶液中离子浓度不大于1×10-5mol/L时,可以认为不含该离子)
(7)滤液2经多步操作还可以获得K2Cr2O7晶体,其操作依次是:加入稀硫酸酸化,加入KCl固体、蒸发浓缩、操作a、过滤、操作b、干燥。
①加硫酸酸化的目的是 。
②操作a、操作b分别是 、 。
【答案】
(1)2,4,3,4,4(2分)
(2)使反应物接触更充分,加快反应速率,提高原料利用率(2分)
(3)MgO、Fe2O3(2分)
(4)CO2(2分)
(5)AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-或者2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-(2分)
(6)5.3(2分)
(7)①使CrO42-转化为Cr2O72-,即CrO42-与H+生成Cr2O72-和水,2CrO42-+2H+![]() Cr2O72-+H2O(2分)
Cr2O72-+H2O(2分)
②冷却结晶(1分)洗涤(1分)
【解析】
试题分析:
(1)根据化合价升降守恒,完成化学方程式的配平:2Cr2O3+4Na2CO3+3O2 ![]() 4Na2CrO4+4CO2↑,故答案为:2,4,3,4,4
4Na2CrO4+4CO2↑,故答案为:2,4,3,4,4
(2)炼铬废渣在焙烧前将球磨粉碎,可以使反应物接触更充分,加快反应速率,提高原料利用率,故答案为:使反应物接触更充分,加快反应速率,提高原料利用率。
(3)根据流程图和题示反应的信息,MgO、Fe2O3与纯碱不反应且不溶于水,因此滤渣1主要含有MgO、Fe2O3,故答案为:MgO、Fe2O3;
(4)根据流程图,Ⅰ焙烧生成的二氧化碳可以参加循环利用,故答案为:CO2;
(5)步骤Ⅲ“碳分”中滤液1中的偏铝酸根离子与二氧化碳反应生成氢氧化铝沉淀,通入少量的二氧化碳反应生成碳酸根离子,通入过量的二氧化碳,反应生成碳酸氢根离子,离子反应方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-或者2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-,故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-或者2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-;
(6)为了使滤液2还原后的溶液中为使Cr3+沉淀完全,c(OH-)<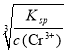 =
=![]() =2×10-9mol/L, 溶液pH>-lg(2×10-9)=5.3, 故答案为:5.3
=2×10-9mol/L, 溶液pH>-lg(2×10-9)=5.3, 故答案为:5.3
(7)①加硫酸酸化可以使CrO42-转化为Cr2O72-,即CrO42-与H+生成Cr2O72-和水,2CrO42-+2H+![]() Cr2O72-+H2O,故答案为:使CrO42-转化为Cr2O72-;
Cr2O72-+H2O,故答案为:使CrO42-转化为Cr2O72-;
②根据从溶液中获得晶体的一般步骤,操作a、操作b分别是冷却结晶、洗涤,故答案为:冷却结晶 洗涤。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案