题目内容
【题目】氯化亚铜(CuCl)是一种重要的化工产品。它不溶于H2SO4、HNO3 和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],n随着环境酸度的改变而改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如图:
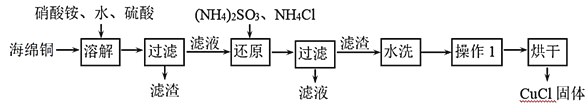
(1)还原过程中主要反应的离子方程式为_______。
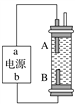
(2)实验室为了加快过滤速度,往往采用抽滤的操作(如图)。仪器A的名称__________,有关抽滤,下列说法正确的是__________
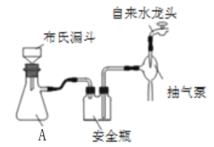
A.抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从吸滤瓶上口倒出
B.在布氏漏斗中放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.在抽滤装置中洗涤晶体时,为减少晶体溶解损失,应使洗涤剂快速通过滤纸
D.减压过滤不宜用于过滤胶状或颗粒太小的沉淀
(3)操作1为马上再洗涤,然后在真空干燥机内于70℃干燥2h,冷却、密封包装。其中最合理的洗涤试剂__________
A. 浓盐酸 B. 浓氨水 C. 无水乙醇 D. 水+乙醇
真空干燥的原因是___________。
(4)随着pH减小,Cu2(OH)4-nCln中铜的质量分数__________
A. 增大 B. 不变 C. 减小 D. 不能确定
【答案】2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+ 吸滤瓶 AD C 防止CuCl在潮湿空气中水解、氧化 C
【解析】
海绵铜加入硫酸和硝酸铵溶解得到溶液主要是硫酸铜,硫酸铵等,加入亚硫酸铵还原硫酸铜、加入氯化铵氯化发生反应2CuSO4+(NH4)2SO3+2NH4Cl+H2O=2CuCl↓+2(NH4)2SO4+H2SO4,过滤得到固体为CuCl,滤液主要是硫酸铵和硫酸,然后利用题干信息,结合物质的性质及要求分析解答。
(1)向含有Cu2+的溶液中加入酱油还原作用的(NH4)2SO3、NH4Cl,发生还原,产生CuCl沉淀,同时产生硫酸,反应的离子方程式为2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+;
(2)根据仪器A的结构可知该仪器名称是吸滤瓶;
A.抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,以防止倒吸现象的发生,最后将滤液从吸滤瓶上口倒出,A正确;
B.在布氏漏斗中放入滤纸后,用玻璃棒引流移溶液和沉淀,再打开水龙头抽滤,B错误;
C.在抽滤装置中洗涤晶体时,应将洗涤剂缓慢通过滤纸,让洗涤剂和晶体充分接触,C错误;
D.颗粒太小的沉淀易在滤纸上形成一层致密的沉淀,溶液不易透过,所以减压过滤不宜用于过滤胶状或颗粒太小的沉淀,D正确;
故合理选项是AD;
(3)操作1为马上再洗涤,目的是为了洗去表面的杂质,为快速干燥,要用酒精洗涤,然后在真空干燥机内于70℃干燥2h,冷却、密封包装,故合理选项是C;
真空干燥的目的防止CuCl在潮湿空气中水解氧化;
(4)随着平pH值减小,[Cu2(OH)4-nCln]中4-n减小,n增大,则铜的含量减小,故合理选项是C。

 阅读快车系列答案
阅读快车系列答案【题目】二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。
Ⅰ.从热力学角度研究反应
(1) C(s)+O2(g)![]() CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)![]() 2CO(g) ΔH2=+172.5 kJ·mol-1
2CO(g) ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)![]() SO2(g) ΔH3=-296.0 kJ·mol-1
SO2(g) ΔH3=-296.0 kJ·mol-1
写出CO 还原SO2的热化学方程式:_________________。
(2)关于CO还原SO2的反应,下列说法正确的是______。
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增大SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,NO的平均反应速率v(NO)=___________,当升高反应温度,该反应的平衡常数K___________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
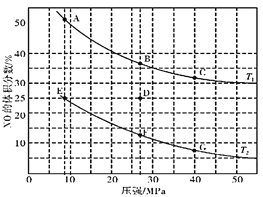
(4)①某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因_____________;在1100kPa时,NO2的体积分数为___________。
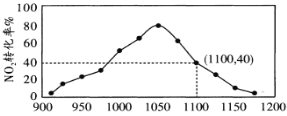
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________(计算表达式表示);已知:气体分压(P分)=气体总压(P总)×体积分数。
【题目】肉桂酸(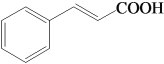 )主要用于香精香料、食品添加剂、有机合成等方面,它的合成原理为
)主要用于香精香料、食品添加剂、有机合成等方面,它的合成原理为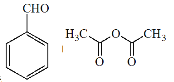
![]()
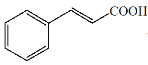 +CH3COOH
+CH3COOH
主要试剂及其物理性质:
名称 | 相对分 子质量 | 性状 | 密度/ (g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解度/(g/100 mL溶剂) | ||
水 | 醇 | 醚 | ||||||
苯甲醛 | 106 | 无色 液体 | 1.044 | -26 | 178~179 | 微溶 | 溶 | 溶 |
乙酸酐 | 102 | 无色 液体 | 1.082 | -73 | 138~140 | 反应 | 溶 | 难溶 |
肉桂酸 | 148 | 白色 粉末 | 1.248 | 133~134 | 300 | 微溶 | 溶 | 溶 |
试剂用量:
试剂名称 | 苯甲醛 | 乙酸酐 | 无水碳酸钾 | 10%氢氧化钠 | 浓盐酸 | 活性炭 |
试剂用量 | 3.0 mL | 5.5 mL | 4~5 g | 40 mL | 25 mL | 1.0 g |
实验仪器如下:
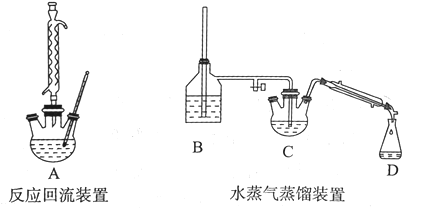
请回答下列问题:
(1)实验准备阶段:在组装实验仪器前要确保反应回流装置彻底干燥,其原因是:_______。
(2)将3.0 mL苯甲醛、5.5 mL乙酸酐和4.00 g无水碳酸钾依次加人250 mL三颈烧瓶中摇匀,烧瓶底部有白色颗粒状固体生成,上部液体无色透明,反应剧烈,有白烟冒出。搭建好回流装置后,开始加热回流。加热回流时控制反应呈微沸状态,加热温度不能太高的原因:_____。
(3)实验结束后,向三颈烧瓶中加人40 mL 10%的氢氧化钠溶液和20 mL的水,可观察到母液体系分为油相和水相。将装置改为水蒸气蒸馏装置,开始加热蒸馏,使油相中的苯甲醛随水蒸气离开母液,开始收集。加人NaOH的作用是:__________。B装置中的长玻璃导管的作用是:_______。水蒸气蒸馏装置中需要加热的仪器有____(填装置序号)。
(4)对蒸气发生器进行加热,待蒸气稳定后再通人烧瓶中的液面下,开始蒸气蒸馏,待检测馏出物中无油滴后停止蒸馏。加人1.0 g活性炭脱色,热过滤。活性炭脱色的原理是______。
(5)加入25 mL的浓盐酸,冰水浴,烧杯中有白色颗粒出现。抽滤(用冰水洗涤),烘箱干燥,称量。称重得m=0.35 g。则该反应的产率约为_____(结果精确至0.1% )。
【题目】(1)根据A~E几种烃分子的结构填空。
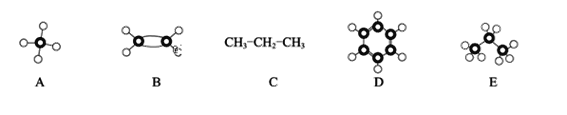
上述分子中属于C的同系物的是_____________(填字母序号)。
(2)随着工业的发展和社会的进步,人们日益关注环境问题。
①下列物质属于室内空气污染物的是__________________(填字母序号,下同);
A CO2 B 甲醛 C N2
②按照垃圾分类的方法,易拉罐瓶属于________________________;
A 可回收物 B 可堆肥垃圾
③工业废水需处理达标后才能排放。下列废水处理的方法合理的是__________。
A 用氯气除去废水中的悬浮物 B 用中和法除去废水中的酸
C 用明矾除去废水中的重金属离子
(3)化学是材料科学发展的基础,合理使用材料有利于人类的生产和生活。
①在一定条件下,将某种单体进行加聚反应得到一种如下图所示的导电性塑料:
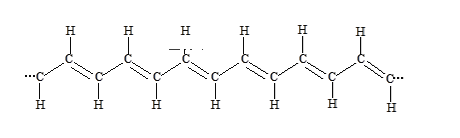
则合成该塑料的单体为___________ (填字母序号,下同);
A 乙炔 B 乙烯 C 乙烷 D 甲烷
②工业炼铁通常采用的方法是__________;
A 加热分解法 B 电解法 C 高温还原法
③某同学欲探究铁在NaCl溶液、蒸馏水和空气中锈蚀的快慢,设计了如下实验。
实验序号 | A | B | C |
实验 内容 |
|
|
|
一周后,试管中铁钉锈蚀程度最大的是__________;
④将质量相同的铁片、铜片用导线连接后浸入硫酸铜溶液中,构成原电池,工作一段时间后铜片质量与铁片质量相差12 g,则理论上导线中通过______mol电子。