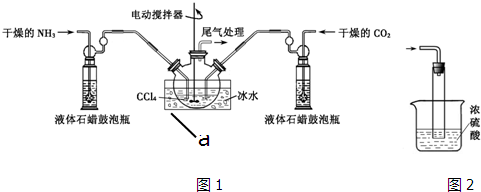
题目内容
16.四氯化钛是无色液体,沸点为136℃.它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O═TiOCl2+2HCl↑),在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体.下图是实验室制备TiCl4的反应装置,其主要操作步骤如下:①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水.
试回答下列问题:
(1)正确的操作顺序为(填序号)③①④②.
(2)装置A中的反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)C装置中的反应方程式为:TiO2+2Cl2+2C $\frac{\underline{\;650℃~850℃\;}}{\;}$TiCl4+2CO.
(4)操作①的目的是排尽装置内的空气,避免TiCl4遇空气中水蒸气发生水解.
(5)装置D中冷凝管进水口的位置是(填a或b)b,装置E的作用是吸收多余的Cl2及挥发的HCl,以免污染空气.
分析 (1)实验时,先装入药品,然后通入二氧化碳,将容器中的水蒸气、氧气等排除,加热反应,反应完毕后,继续通入二氧化碳,将装置内的氯气、CO等排出;
(2)装置A中用于制备氯气,反应加热,应为二氧化锰和浓盐酸的反应;
(3)由于TiO2、C、Cl2混合物在高温条件下制得TiCl4和一种有毒气体,根据化学反应中元素种类不变的规律可知:该有毒气体含有碳、氧两种元素,由碳、氧两种元素组成的有毒气体只有一氧化碳;因此TiO2、C、Cl2混合物在高温条件下反应生成TiCl4和一氧化碳;
(4)四氯化钛极易水解,能与装置中的空气里的水蒸气反应;
(5)根据采用逆流冷却的效果好判断进水口,反应中有未反应的氯气及挥发出来的氯化氢,会污染空气,所以要用氢氧化钠溶液进行尾气吸收.
解答 解:(1)实验时,先装入药品,然后通入二氧化碳,将容器中的水蒸气、氧气等排除,加热反应,反应完毕后,继续通入二氧化碳,将装置内的氯气、CO等排出,操作顺序为③①④②,
故答案为:③①④②;
(2)装置A中用于制备氯气,反应加热,应为二氧化锰和浓盐酸的反应,反应的离子方程式为MnO2+4H++2 Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2 Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)由于TiO2、C、Cl2混合物在高温条件下制得TiCl4和一种有毒气体,根据化学反应中元素种类不变的规律可知:该有毒气体含有碳、氧两种元素,由碳、氧两种元素组成的有毒气体只有一氧化碳;因此TiO2、C、Cl2混合物在高温条件下反应生成TiCl4和一氧化碳,该反应的化学方程式为:TiO2+2Cl2+2C $\frac{\underline{\;650℃~850℃\;}}{\;}$TiCl4+2CO,
故答案为:TiO2+2Cl2+2C $\frac{\underline{\;650℃~850℃\;}}{\;}$TiCl4+2CO;
(4)四氯化钛极易水解,能与装置中的空气里的水蒸气反应,所以在通Cl2前先通入CO2气体并持续一段时间,排尽装置中的空气,避免TiCl4 遇空气中水蒸气发生水解,
故答案为:排尽装置内的空气,避免TiCl4 遇空气中水蒸气发生水解;
(5)根据采用逆流冷却的效果好可知,进水口应为b,反应中有未反应的氯气及挥发出来的氯化氢,会污染空气,所以要用氢氧化钠溶液进行尾气吸收,所以E的作用是吸收多余的Cl2及挥发的HCl,以免污染空气,
故答案为:b;吸收多余的Cl2及挥发的HCl,以免污染空气.
点评 本题考查物质的制备和性质探究,为高频考点,侧重于学生的分析能力和实验能力的考查,要根据实验原理提出假设,再结合物质的性质加以验证,侧重于考查学生的实验探究能力和对知识的应用能力,题目难度中等.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案| A. | 平衡向逆反应方向移动 | B. | a+b<c+d | ||
| C. | Y的体积分数减小 | D. | X的转化率下降 |
| 选项 | 反应 | 反应 |
| A | 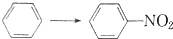 | CH2═CH2→CH3CH2Cl |
| B | CH3CH2Cl→CH3CH2OH | CH3CH2OH→CH3COOCH2CH3 |
| C | CH3CH2OH→CH2═CH2 | CH3CH2OH→CH3CHO |
| D | 油脂→甘油 |  |
| A. | A | B. | B | C. | C | D. | D |
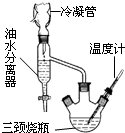 乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:①部分物质的沸点:
| 物 质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
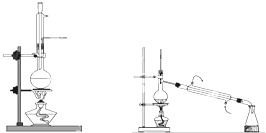
该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石…;装上油水分离器和冷凝管,缓慢加热回流至反应完全.
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗.
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏.
(1)第一步操作中,还缺少的试剂是浓硫酸;加入苯的目的是形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;实验过程中,酯化反应进行完全的标志是油水分离器中液体不再增加.
(2)第二步中证明“水洗”已经完成的实验方案是测定水洗液的pH至7.
(3)第三步可以得到较纯净的乳酸乙酯,为获得更纯净的乳酸乙酯,可采用层析法.
(4)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有5个峰.
| A. | 电解精炼铜:阳极质量的减小等于阴极质量的增加 | |
| B. | 氯碱工业:在阴极需要不断加入含有NaOH的蒸馏水 | |
| C. | 合成氨工业:使用催化剂只加快反应速率不影响化学平衡 | |
| D. | 硫酸工业:SO2的转化率高达93.5%~98%,因此接触氧化后的尾气可以直接排放 |
 【实验化学】
【实验化学】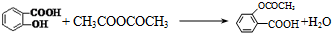
 .
.