题目内容
X、Y、Z、M、N代表五种金属,有以下反应:
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)=Z(OH)2+H2↑;
④水溶液中,X+Y2+=X2++Y。
则这五种金属的活动性由强到弱的顺序为( )
| A.Z>X>Y>M>N | B.Z>Y>X>M>N |
| C.Z>X>Y>N>M | D.X>Y>M>N>Z |
A
解析试题分析:①Y与M用导线连接放入稀硫酸中,M上冒气泡;证明M为原电池是正极,所以活动性Y>M;②在原电池反应中,电子流出的电极为负极,电子流入的电极为正极,由于电子从M极流出,经过外电路,流入N极,所以活动性M>N;③Z+2H2O(冷水)=Z(OH)2+H2↑。证明Z的活动性很强。在题目提供的所有的元素中是最强的。④水溶液中,X+Y2+=X2++Y,则证明活动性X>Y。所以这五种金属的活动性由强到弱的顺序为Z>X>Y>M>N 。选项为A。
考点:考查金属活动性顺序的比较方法的知识。

 阶梯计算系列答案
阶梯计算系列答案下列叙述中,正确的是
①锌跟稀硫酸反应制取氢气,加入少量CuSO4溶液能提高反应速率 ②镀层破损后,白铁(镀锌的铁)比马口铁(铁锡的铁)更易腐蚀; ③电镀时应把镀件置于电解槽的阴极 ;④冶炼铝时,把氧化铝加热成为熔融体后电解 ⑤钢铁表面常易腐蚀生成Fe2O3·nH2O
| A.①②③④⑤ | B.①③④⑤ | C.①③⑤ | D.②④ |
下列叙述不正确的是
| A.金属腐蚀的本质是金属原子失去电子而被氧化 |
| B.将地下钢管与直流电源的正极相连,用来保护钢管 |
| C.电解饱和食盐水制氢氧化钠,可以用铁做阴极 |
| D.氢氧燃料电池中,氢气在负极发生氧化反应 |
把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能
| A.②⑤ | B.③⑤ | C.①② | D.④⑤ |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢或锂电池的十倍,可连续使用一个月才充一次电,其电池反应为:2CH3OH+3O2+4OH- 2CO32-+6H2O,则下列有关说法不正确的是
2CO32-+6H2O,则下列有关说法不正确的是
| A.放电时化学能转变为电能 | B.放电时CH3OH参与正极反应 |
| C.充电时阴极产生CH3OH | D.充电时每生成1mol CH3OH,则转移6mol电子 |
利用如图所示装置可以模拟钢铁的电化学防护。下列说法正确的是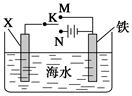
| A.若X为锌棒,开关K置于M处,铁极发生还原反应 |
| B.若X为碳棒,开关K置于N处,X极发生还原反应 |
| C.若X为碳棒,开关K置于N处,可加快铁的腐蚀 |
| D.若X为锌棒,开关K置于M处,可加快铁的腐蚀 |
将右图所示实验装置的K闭合,下列判断正确的是
| A.Zn电极上发生还原反应 |
| B.片刻后盐桥中的Cl-向乙装置中移动 |
| C.片刻后在a点滴加酚酞观察到滤纸变红色 |
| D.片刻后在b点滴加淀粉碘化钾溶液观察到滤纸无变化 |
早在1807年化学家戴维用电解熔融氢氧化钠制得钠: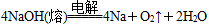 ;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:
;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠: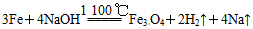 。下列有关说法正确的是
。下列有关说法正确的是
| A.电解熔融氢氧化钠制钠,阳极发生电解反应为2OH--2e-=H2↑+O2↑ |
| B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数不同 |
| D.目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阴极,铁为阳极 |
用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
| A.电子通过盐桥从乙池流向甲池 |
| B.铜导线替换盐桥,原电池仍继续工作 |
| C.开始时,银片上发生的反应是:Ag-e-=Ag+ |
| D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同 |