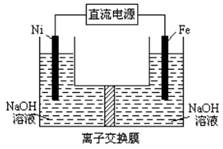
题目内容
把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能
| A.②⑤ | B.③⑤ | C.①② | D.④⑤ |
A
解析试题分析:①锌片、铜片和稀硫酸溶液构成的原电池中,铜作正极,正极上氢离子得电子生成氢气,所以硫酸浓度减小,故①错误;②铜作正极,正极上氢离子得电子生成氢气,发生还原反应,电极反应式为2H++2e-=H2↑,故②正确;③该原电池中锌失电子变成锌离子进入溶液,所以锌作负极,铜作正极,故③错误;④锌失电子通过导线流向铜,所以电子流向为由Zn经导线流入Cu片,即从负极通过导线流向正极,故④错误;⑤原电池是将化学能转变为电能的装置,故⑤正确,故选A。
考点:考查原电池工作原理

下列反应不可用于设计原电池的是( )。
A.2CH3OH+3O2 2CO2+4H2O 2CO2+4H2O |
| B.NaOH+HCl = NaCl+H2O |
| C.Zn+2HCl = ZnCl2+H2↑ |
| D.4Al+3O2+6H2O = 4Al(OH)3 |
用两支惰性电极插入CuSO4溶液中,通电电解,当有1×10-3 mol的OH-放电时,溶液显浅蓝色,则下列叙述正确的是( )
| A.阳极上析出11.2 mL O2(标准状况) | B.阴极上析出32 mg Cu |
| C.阴极上析出11.2 mL H2(标准状况) | D.阳极和阴极质量都无变化 |
X、Y、Z、M、N代表五种金属,有以下反应:
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)=Z(OH)2+H2↑;
④水溶液中,X+Y2+=X2++Y。
则这五种金属的活动性由强到弱的顺序为( )
| A.Z>X>Y>M>N | B.Z>Y>X>M>N |
| C.Z>X>Y>N>M | D.X>Y>M>N>Z |
关于下列各装置图的叙述中,不正确的是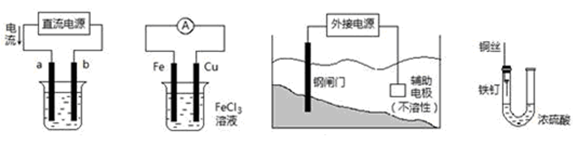
① ② ③ ④
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
金属锌为活泼金属,易被腐蚀。下列关于锌的腐蚀说法正确的是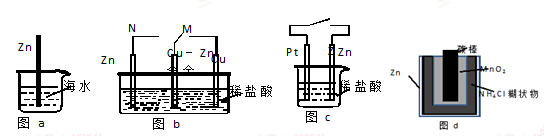
| A.图a中,??入海水中的锌棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由Zn的氧化作用引起的 |
如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是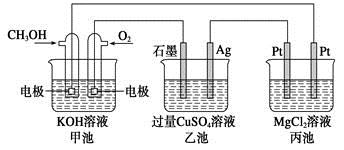
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体 |
铜—锌—稀硫酸组成的原电池,放电一段时间后,溶液的pH将( )
| A.不变 | B.升高 |
| C.降低 | D.无法确定 |