题目内容
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢或锂电池的十倍,可连续使用一个月才充一次电,其电池反应为:2CH3OH+3O2+4OH- 2CO32-+6H2O,则下列有关说法不正确的是
2CO32-+6H2O,则下列有关说法不正确的是
| A.放电时化学能转变为电能 | B.放电时CH3OH参与正极反应 |
| C.充电时阴极产生CH3OH | D.充电时每生成1mol CH3OH,则转移6mol电子 |
B
解析试题分析:放电时,根据电池反应式知,C元素的化合价升高,所以甲醇所在电极为原电池的负极,O元素的化合价降低,所以通入氧气的极为原电池的正极,负极上发生氧化反应,正极上发生还原反应,充电时,阴阳极上电极反应式为正负极的电极反应式的逆反应,以此来解答。A、放电时是原电池,化学能转变为电能,A正确;B、放电时,负极上甲醇失电子发生氧化反应,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故B错误;C、充电时,碳酸根离子得电子生成甲醇,则有CH3OH生成的电极为阴极,故C正确;D、充电时,碳元素的化合价从+4价降低到-2价,得到6个电子,则电充电时每生成1mol CH3OH,则转移6mol电子,故D正确,答案选B。
考点:考查电化学原理的应用

 阅读快车系列答案
阅读快车系列答案如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当电路中通过的电子都是0.1mol时,下列说法正确的是( )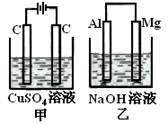
| A.相同条件下产生气体的体积:V甲=V乙 |
| B.溶液pH值变化:甲减小乙增大 |
| C.溶液的质量变化:甲减小乙增大 |
| D.电极反应式:甲中阴极:Cu2++2e—= Cu, 乙中负极:Mg - 2e—= Mg2+ |
生物燃料电池是以有机物为燃料,直接或简介利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池。其工作原理如图所示。下列有关说法正确的是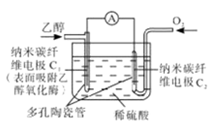
| A.O2在C2电极上得电子,被氧化 |
| B.电子由C2极经外电路流向C1极 |
| C.每转移6mole-,理论上生成22.4LCO2 |
| D.C1极的电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+ |
以下现象与电化腐蚀无关的是
| A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B.生铁比软铁芯(几乎是纯铁)容易生锈 |
| C.铁质器件附有铜质配件,在接触处易生铁锈 |
| D.银质奖牌久置后表面变暗 |
X、Y、Z、M、N代表五种金属,有以下反应:
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)=Z(OH)2+H2↑;
④水溶液中,X+Y2+=X2++Y。
则这五种金属的活动性由强到弱的顺序为( )
| A.Z>X>Y>M>N | B.Z>Y>X>M>N |
| C.Z>X>Y>N>M | D.X>Y>M>N>Z |
化学与科学、技术、社会和环境密切相关。下列有关说法中错误的是
| A.对废旧电池进行回收处理,主要是为了环境保护和变废为宝 |
| B.用电解水的方法制取大量H2,可以缓解能源不足的问题 |
| C.大力开发和应用氢能源有利于实现“低碳经济” |
| D.工业上,不能采用电解MgCl2溶液的方法制取金属镁 |
不久前,美国一个海军航空站安装了一 台250 kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600 ℃~700 ℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2=2H2O, 负极反应为H2+ CO32--2e-=H2O+CO2,则下列推断正确的是 ( )
| A.正极反应为:4OH- =O2+2H2O+4e- | B.放电时 CO32-向负极移动 |
| C.电池供应1 mol水蒸气,转移的电子数为4 mol | D.放电时CO32-向正极移动 |
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-。下列叙述错误的是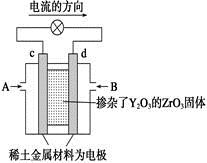
| A.c电极是正极,发生还原反应 |
| B.B口通入的是甲烷,发生氧化反应 |
| C.放电时O2-离子向d极移动 |
| D.d极上的电极反应式为:CH4+4O2-+8e-=CO2↑+2H2O |
燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图。下列说法正确的是 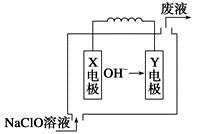
| A.镁作Y电极 |
| B.电池工作时,Na+向负极移动 |
| C.废液的pH大于NaClO溶液的pH |
D.X电极上发生的反应为ClO-+2H2O-4e-=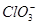 +4H+ +4H+ |