题目内容
下列叙述中,正确的是
①锌跟稀硫酸反应制取氢气,加入少量CuSO4溶液能提高反应速率 ②镀层破损后,白铁(镀锌的铁)比马口铁(铁锡的铁)更易腐蚀; ③电镀时应把镀件置于电解槽的阴极 ;④冶炼铝时,把氧化铝加热成为熔融体后电解 ⑤钢铁表面常易腐蚀生成Fe2O3·nH2O
| A.①②③④⑤ | B.①③④⑤ | C.①③⑤ | D.②④ |
B
解析试题分析:①锌跟稀硫酸反应制取氢气,若加入少量CuSO4溶液,则Zn与CuSO4溶液发生置换反应,产生Cu单质。Zn与置换出来的Cu及稀硫酸构成原电池,因此能提高反应速率。正确。②镀层破损后,白铁(镀锌的铁)中由于Zn比Fe活泼,作原电池的负极,仍然在保护Fe,防止其被腐蚀,而马口铁(铁锡的铁)中也构成了原电池,由于活动性Fe比Sn强,Fe作负极,会加快Fe的腐蚀。因此后者更易腐蚀。错误。③电镀时应把镀件置于电解槽的阴极,把镀层金属作阳极,用含有镀层金属离子的溶液作电镀溶液。正确。④冶炼铝时,应该电解熔融的氧化铝。因此要先把氧化铝加热成为熔融体后电解。正确。 ⑤钢铁表面常因发生原电池反应而腐蚀。由于Fe比杂质C活泼。所以Fe作原电池的负极而被氧化发生,最终发生得到的是Fe2O3·nH2O。正确。因此正确的是①③④⑤。选项为B。
考点:考查原电池反应的应用的知识。

某混合溶液中只含有两种溶质NaCl和H2SO4,且n(NaCl)︰n(H2SO4)=3︰1。若以石墨电极电解该溶液,下列推断中不正确的是 ( )
| A.阴极产物为H2 | B.阳极先析出Cl2,后析出O2 |
| C.电解液的pH不断增大,最终大于7 | D.整个电解的过程实质是电解水 |
分析下图所示的四个原电池装置,其中结论正确的是 ( )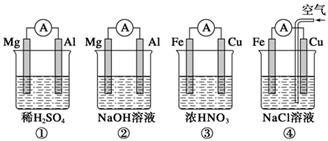
| A.①②中Mg作负极,③④中Fe作负极 |
| B.②中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑ |
| C.③中Fe作负极,电极反应式为Fe-2e-=Fe2+ |
| D.④中Cu作正极,电极反应式为2H++2e-=H2↑ |
下列反应不可用于设计原电池的是( )。
A.2CH3OH+3O2 2CO2+4H2O 2CO2+4H2O |
| B.NaOH+HCl = NaCl+H2O |
| C.Zn+2HCl = ZnCl2+H2↑ |
| D.4Al+3O2+6H2O = 4Al(OH)3 |
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当电路中通过的电子都是0.1mol时,下列说法正确的是( )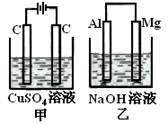
| A.相同条件下产生气体的体积:V甲=V乙 |
| B.溶液pH值变化:甲减小乙增大 |
| C.溶液的质量变化:甲减小乙增大 |
| D.电极反应式:甲中阴极:Cu2++2e—= Cu, 乙中负极:Mg - 2e—= Mg2+ |
X、Y、Z、M、N代表五种金属,有以下反应:
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)=Z(OH)2+H2↑;
④水溶液中,X+Y2+=X2++Y。
则这五种金属的活动性由强到弱的顺序为( )
| A.Z>X>Y>M>N | B.Z>Y>X>M>N |
| C.Z>X>Y>N>M | D.X>Y>M>N>Z |
用惰性电极电解某金属元素R的硝酸盐R(NO3)n溶液,通电一段时间后,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的相对原子质量为M,设NA为阿伏加德罗常数的值,下列叙述中不正确的是
A.电路中通过电子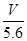 NA NA | B.n = 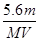 |
C.溶液中H+增加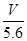 NA NA | D.n = 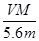 |
燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图。下列说法正确的是 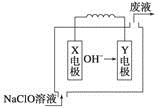
| A.镁作Y电极 |
| B.电池工作时,Na+向负极移动 |
| C.废液的pH大于NaClO溶液的pH |
| D.X电极上发生的反应为ClO-+2H2O-4e-===ClO3-+4H+ |
氯碱工业常利用阳离子交换膜电解食盐水,下列说法不正确的是
| A.随着电解的进行,c(NaCl)降低,需不断补充饱和食盐水 |
| B.电解过程中采用增大阳极区溶液pH的方法,可以减少Cl2在水中的溶解量 |
| C.阳离子交换膜的作用是阻止OH-移向阳极,以使氢氧化钠在阴极区富集 |
| D.阳极表面用钛氧化物涂层处理,目的是降低电解产物Cl2对电极的腐蚀 |