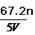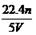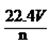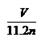题目内容
11.9g金属锡(Sn)跟100mL12mol·L-1HNO3共热一段时间。完全反应后测定溶液中c(H+)为8mol·L-1,溶液体积仍为100mL。产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol。由此推断氧化产物可能是
| A.SnO2·4H2O | B.Sn(NO3)4 |
| C.Sn(NO3)2 | D.Sn(NO3)2和Sn(NO3)4 |
A
解析试题分析:
nHNO3=0.1*12=1.2(mol) c(H+)与C(NO3-)共存,C余HNO3=0.1*8=0.8(mol)
被还原的硝酸为1.2-0.8=0.4 (mol)
产生的气体全部被氢氧化钠溶液: 2NO2————2NaOH
2
0.4
硝酸的化合价降低:HNO3(N:+5)------ NO2(N:+4)
1 1
0.4 0.4
硝酸的化合价降低=金属锡化合价升高数 n锡=11.9/119=0.1(mol)共化合价升高0.4 mol,锡被氧化为+4,
由前面知没有与锡结合的硝酸根,所以锡以氧化物的形式存在SnO2·4H2O,选A。
考点:考查化学计算等相关知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案能正确描述氮原子或氮分子的化学用语是
A.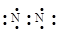 | B.1s22s22p5 | C. | D.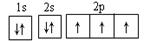 |
将10.92 g锌铁合金粉末加入含0.4 mol H+的稀硝酸和稀硫酸的混合溶液中,充分反应后收集得到的气体体积(标准状况下)可能为(假设气体全部逸出,稀硝酸的还原产物是NO)
| A.2.4 L | B.3.6 L | C.4.8 L | D.6.0 L |
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
| A.两种气体的压强相等 | B.O2比O3质量小 |
| C.两种气体的分子数目相等 | D.两种气体的氧原子数目相等 |
足量的铜与一定量的浓硝酸反应得到硝酸铜溶液和NO、N2O4、NO2的混合气体,这些气体与1.68升O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则和铜反应的硝酸的物质的量可能是( )
| A.0.4mol | B.0.55mol | C.0.6mol | D.0.65mol |
将7.8g Na2O2和2.7g Al同时放入一定量的水中,充分反应后得到100mL溶液,再向该溶液中缓慢通入HCl气体3.36L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是
| A.反应过程中得到3.36L(标准状况)的气体 |
| B.反应结束得到3.9g的沉淀 |
| C.反应结束得到的溶液中c(Na+)= c(Cl-)+ c(OH-) |
| D.反应结束得到的溶液中c(NaCl)="1.0" mol·L-1 |
下列化学用语正确的是
A.重水的分子式: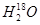 |
B.Mg2+的结构示意图: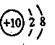 |
| C.乙酸的分子式:CH3COOH |
D.HCIO的电子式: |