题目内容
(4分)已知Na2SO3易被空气氧化变质,欲用氧化还原滴定法来测定实验室里Na2SO3的纯度。取实验室里Na2SO3样品63g,溶于水配成250mL溶液。从其中取出25mL Na2SO3溶液用0.4mol·L-1酸性KMnO4溶液滴定,当溶液刚好变为紫色且半分钟不褪色时,用去40mL酸性KMnO4溶液(已知:5SO32-+2MnO4-+6H+ 5SO42-+2Mn2++3H2O)。则实验室里的Na2SO3的纯度为多少?
(4分)
2KMnO4~5Na2SO3
n(KmnO4)=0.4×0.04=0.016(mol)
n(Na2SO3)=0.04mol(过程2分)
m(Na2SO3)=0.04×10×126=50.4(g)
w(Na2SO3)=50.4÷63×100%=80%(结果2分)
解析试题分析:由题目中的方程式可以得到关系式:5Na2SO3~2KMnO4,可求得Na2SO3的物质的量,然后根据滴定时所取的Na2SO3溶液为所配溶液的 及Na2SO3的摩尔质量可求出原物质中Na2SO3的质量,进一步计算即可求得其纯度。
及Na2SO3的摩尔质量可求出原物质中Na2SO3的质量,进一步计算即可求得其纯度。
考点:考查有关化学方程式的计算,考查考生利用关系式进行计算的能力。

一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是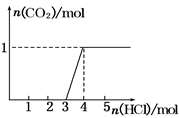
| A.通入的CO2气体为22.4 L |
| B.A溶液中n(NaOH)=2n(Na2CO3) |
| C.A溶液中既含Na2CO3,又含NaHCO3 |
| D.A溶液中一定只有Na2CO3 |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.1 L 1.0 mol/L的NH4Al(SO4)2溶液中含有的氧原子数为8NA |
| B.25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C.标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA |
| D.1 mol FeCl3完全水解得到的Fe(OH)3胶体中含有的胶粒的数目为1NA |
下列有关说法不正确的是(NA表示阿伏加德罗常数)( )
| A.向硫酸酸化的KMnO4溶液中滴加BaCl2溶液,会产生白色沉淀和黄绿色气体 |
| B.室温下,42.0g乙烯和丁烯的混合气体中含有的碳原子数为3NA |
| C.CO32-离子的VSEPR模型为平面三角形 |
| D.19.5gNa2O2投入过量的水中,反应中转移的电子数为0.5NA |
以NA表示阿伏伽德罗常数,下列说法正确的是
| A.分子总数为NA的NO2和CO2混合气体含有的氧原子数为2NA |
| B.标准状况下,由Na2O2制的11.2LO2反应转移的电子束为2NA |
| C.18.0g重水(D2O)与20gNe所含有的电子数都为10NA |
| D.0.5mol O3与11.2L O2所含的分子数都为0.5NA |
下列表示方法正确的是( )
A.铜的原子结构示意图: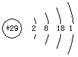 |
| B.S2- 核外电子排布式:[Ne] 2s23p6 |
C.O原子处于基态的轨道表示式: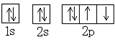 |
D.用电子式表示MgCl2的形成:Mg:+ → →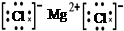 |
若NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
| A.16g CH4与18 g NH4+所含质子数相等 |
| B.1mol 苯分子中含有碳碳双键数为3NA |
| C.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22. 4L |
| D.7.8 g Na2O2中含有的离子总数目为0.3NA |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温常压下,5.6L CH4含C—H键数目为NA |
| B.常温常压下,100g17%H2O2水溶液含氧原子总数为NA |
| C.标准状况下,5.6L O2与适量Na加热反应,转移电子数一定为NA |
| D.常温常压下,14g乙烯与丙烯的混合气体,含碳原子总数为NA |
11.9g金属锡(Sn)跟100mL12mol·L-1HNO3共热一段时间。完全反应后测定溶液中c(H+)为8mol·L-1,溶液体积仍为100mL。产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol。由此推断氧化产物可能是
| A.SnO2·4H2O | B.Sn(NO3)4 |
| C.Sn(NO3)2 | D.Sn(NO3)2和Sn(NO3)4 |