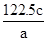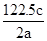题目内容
将10.92 g锌铁合金粉末加入含0.4 mol H+的稀硝酸和稀硫酸的混合溶液中,充分反应后收集得到的气体体积(标准状况下)可能为(假设气体全部逸出,稀硝酸的还原产物是NO)
| A.2.4 L | B.3.6 L | C.4.8 L | D.6.0 L |
AB
解析试题分析:假设0.4molH+,全部为HNO3,即硝酸为0.4mol,全部还原生成NO为0.1mol(3Zn(Fe)+8HNO3=3Zn(NO3)2+2NO↑+4H2O),假设全部为H2SO4,生成0.2molH2,故产生的气体在0.1~0.2mol之间,及标况下2.24L~4.48L,故答案选AB。
考点:化学计算,氧化还原反应。

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
下列有关说法不正确的是(NA表示阿伏加德罗常数)( )
| A.向硫酸酸化的KMnO4溶液中滴加BaCl2溶液,会产生白色沉淀和黄绿色气体 |
| B.室温下,42.0g乙烯和丁烯的混合气体中含有的碳原子数为3NA |
| C.CO32-离子的VSEPR模型为平面三角形 |
| D.19.5gNa2O2投入过量的水中,反应中转移的电子数为0.5NA |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温常压下,5.6L CH4含C—H键数目为NA |
| B.常温常压下,100g17%H2O2水溶液含氧原子总数为NA |
| C.标准状况下,5.6L O2与适量Na加热反应,转移电子数一定为NA |
| D.常温常压下,14g乙烯与丙烯的混合气体,含碳原子总数为NA |
一种新的储氢方法,其原理是NaHCO3+ H2 HCOONa+ H2O。下列叙述正确的是
HCOONa+ H2O。下列叙述正确的是
| A.储氢、释氢的过程均无能量变化 |
| B.NaHCO3、HCOONa均含有离子键和共价键 |
| C.储氢过程中NaHCO3被氧化 |
| D.释氢过程中每消耗0.1molH2O放出2.24L的H2 |
将Na2O2、HCl和Al2O3一起溶于一定量的水中,完全反应后,测得所得溶液中只含有Na+、AlO2-、Cl-(不考虑AlO2-的水解和H2O的电离),则Na2O2、HCl、Al2O3的物质的量之比不可能的是
| A.2;2;1 | B.3;3;1 | C.3;4;1 | D.4;6;1 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.1mol Na2O2晶体中共含有4NA个离子 |
| B.0.1 mol A1C13完全水解转化为氢氧化铝胶体,生成0. 1 NA个胶粒 |
| C.常温常压下16gO2和O3混合气体含有NA个氧原子 |
| D.电解精炼铜时每转移NA个电子,阳极溶解32g铜 |
11.9g金属锡(Sn)跟100mL12mol·L-1HNO3共热一段时间。完全反应后测定溶液中c(H+)为8mol·L-1,溶液体积仍为100mL。产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol。由此推断氧化产物可能是
| A.SnO2·4H2O | B.Sn(NO3)4 |
| C.Sn(NO3)2 | D.Sn(NO3)2和Sn(NO3)4 |
下列化学用语正确的是 ( )
| A.HCN分子的结构式:H-C≡N |
| B.乙烯的结构简式:CH2CH2 |
C.F-离子结构示意图: |
D.二氧化碳的电子式: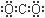 |