题目内容
【题目】一氯甲烷等卤代烃跟苯的反应如图所示,(无机小分子产物略去)。下列说法正确的是

A. 该反应属于化合反应
B. b的二氯代物有6种结构
C. 1mol b加氢生成饱和烃需要6molH2
D. C5H11Cl的结构有8种
【答案】D
【解析】
A、一氯甲烷等卤代烃跟苯的反应生成甲苯和HCl;
B、甲苯的苯环上的二氯代物有6种,甲基上的氢也可以被取代;
C、1mol b加氢生成饱和烃需要3molH2;
D、戊烷的同分异构体有正、异、新三种,再分析氯的位置异构。
A、一氯甲烷等卤代烃跟苯的反应生成甲苯和HCl,属于取代反应,故A错误;
B、甲苯的苯环上的二氯代物有6种,甲基上的氢也可以被取代,故B错误;
C、1mol b加氢生成饱和烃需要3molH2,故C错误;
D、戊烷的同分异构体有正、异、新三种,再分析氯的位置异构分别有3种、4种、1种,故D正确。
故选D。

【题目】硫的化合物在科研、生活及化学工业中具有重要的作用。
(1)废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
pH | 3 | 5 | 7 | 9 | 11 |
c(S2-)/ (mol·L-1) | 1.4×10-15 | 1.4×10-11 | 6.8×10-8 | 1.3×10-5 | 1.3×10-3 |
某溶液含0.020 mol·L-1 Mn2+、0.10 mol·L-1 H2S,当溶液pH=5时,Mn2+开始沉淀,MnS的溶度积为_______。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g)![]() 2H2(g)+S2(g),在膜反应器中分离出H2。
2H2(g)+S2(g),在膜反应器中分离出H2。
①在密闭容器中,充入0.10 mol H2S(g),发生反应2H2S(g)![]() 2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如下图。
2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如下图。
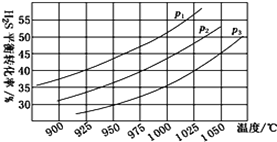
图中压强p1、p2、p3由大到小的顺序为________________________________。
②若容器的容积为2.0 L,则压强为p3,温度为950 ℃时,反应经3 h达到平衡,化学反应速率v(S2)=____。
③若压强p2=7.2 MPa、温度为975 ℃时,该反应的平衡常数Kp=__________________(用平衡分压代替平衡浓度,分压=总压×物质的量分数,结果保留两位有效数字)。
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) CH3OH(g) △H<0
(1)在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_________mol/(L·min),该温度下平衡常数K=___________,若平衡后增大压强,则K值_________(填“增大”、“减小”或“不变”)。
(2)在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) CH3OH(g) △H<0,反应达到平衡的是___________;
A、压强保持不变 B、气体的密度保持不变
C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1
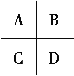
(3)如图是甲醇燃料电池结构示意图,C是________(填“正”或“负”)极,写出此电极的电极反应式__________________________________________。

(4)若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为________mol/L。