题目内容
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) CH3OH(g) △H<0
(1)在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_________mol/(L·min),该温度下平衡常数K=___________,若平衡后增大压强,则K值_________(填“增大”、“减小”或“不变”)。
(2)在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) CH3OH(g) △H<0,反应达到平衡的是___________;
A、压强保持不变 B、气体的密度保持不变
C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1
(3)如图是甲醇燃料电池结构示意图,C是________(填“正”或“负”)极,写出此电极的电极反应式__________________________________________。

(4)若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为________mol/L。
【答案】 0.075 3(mol/L)-2 不变 BD 负 CH3OH+8OH--6e-=CO32-+6H2O 5
【解析】(1)由表中数据可知,20min反应到达平衡,恒温恒容下,压强之比等于物质的量之比,则平衡时混合气体总物质的量为(2+4)mol×![]() =3mol,根据三段式求出平衡时各物质的物质的量,然后根据v=
=3mol,根据三段式求出平衡时各物质的物质的量,然后根据v=![]() 计算v(CO);根据K=
计算v(CO);根据K=![]() 计算平衡常数;平衡常数只与温度有关;
计算平衡常数;平衡常数只与温度有关;
(2)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,据此判断;
(3)根据电子的流动方向可知,电极C为负极,据此分析解答;
(4)用石墨做电极电解100mL CuSO4溶液,阳极上氢氧根离子放电生成氧气,阴极上铜离子和氢离子放电,根据得失电子守恒求出生成的铜的物质的量,原CuSO4溶液的物质的量与铜的物质的量相等,据此分析解答。
(1)由表中数据可知,20min反应到达平衡,恒温恒容下,压强之比等于物质的量之比,则平衡时混合气体总物质的量为(2+4)mol×![]() =3mol,设反应的CO物质的量为x,
=3mol,设反应的CO物质的量为x,
CO(g)+2H2(g)CH3OH(g)
起始量(mol):2 4 0
变化量(mol):x 2x x
平衡量(mol):2-x 4-2x x
则(2-x)+(4-2x)+x=3mol,解得x=1.5mol,
从反应开始到20min时,以CO表示的平均反应速率v(CO)=![]() =0.075mol/(Lmin);该温度下平衡常数K=
=0.075mol/(Lmin);该温度下平衡常数K=![]() =
=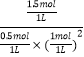 =3(mol/L)-2;若平衡后增大压强,温度不变,平衡常数不变,故答案为:0.075;3(mol/L)-2;不变;
=3(mol/L)-2;若平衡后增大压强,温度不变,平衡常数不变,故答案为:0.075;3(mol/L)-2;不变;
(2)A、该反应前后气体的物质的量发生变化,压强保持不变,能够说明是平衡状态,不选;B、气体的体积不变,质量不变,气体的密度始终保持不变,不能说明是平衡状态,选;C、该反应前后气体的物质的量发生变化,质量不变,气体平均摩尔质量保持不变,能够说明是平衡状态,不选;D、任何时候都存在v(H2):v(CH3OH)=2:1,不能说明是平衡状态,选;故选BD;
(3)根据电子的流动方向可知,电极C为负极,通入的是气体燃料甲醇,电极D为正极,通入的是氧气或空气,负极发生氧化反应,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故答案为:负;CH3OH+8OH--6e-=CO32-+6H2O;
(4)用石墨做电极电解100mL CuSO4溶液,阳极上氢氧根离子放电生成氧气,物质的量为![]() =0.5mol,阴极上开始为铜离子放电,后来氢离子放电生成氢气,其中氢气的物质的量为
=0.5mol,阴极上开始为铜离子放电,后来氢离子放电生成氢气,其中氢气的物质的量为![]() =0.5mol,根据得失电子守恒,生成的铜的物质的量=
=0.5mol,根据得失电子守恒,生成的铜的物质的量=![]() =0.5mol,则原CuSO4溶液的物质的量浓度为
=0.5mol,则原CuSO4溶液的物质的量浓度为![]() =0.5mol/L故答案为:0.5。
=0.5mol/L故答案为:0.5。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案