题目内容
【题目】硫的化合物在科研、生活及化学工业中具有重要的作用。
(1)废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
pH | 3 | 5 | 7 | 9 | 11 |
c(S2-)/ (mol·L-1) | 1.4×10-15 | 1.4×10-11 | 6.8×10-8 | 1.3×10-5 | 1.3×10-3 |
某溶液含0.020 mol·L-1 Mn2+、0.10 mol·L-1 H2S,当溶液pH=5时,Mn2+开始沉淀,MnS的溶度积为_______。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g)![]() 2H2(g)+S2(g),在膜反应器中分离出H2。
2H2(g)+S2(g),在膜反应器中分离出H2。
①在密闭容器中,充入0.10 mol H2S(g),发生反应2H2S(g)![]() 2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如下图。
2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如下图。
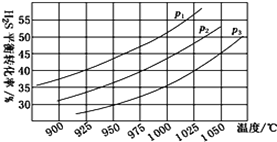
图中压强p1、p2、p3由大到小的顺序为________________________________。
②若容器的容积为2.0 L,则压强为p3,温度为950 ℃时,反应经3 h达到平衡,化学反应速率v(S2)=____。
③若压强p2=7.2 MPa、温度为975 ℃时,该反应的平衡常数Kp=__________________(用平衡分压代替平衡浓度,分压=总压×物质的量分数,结果保留两位有效数字)。
【答案】2.8×10-13 p3>p2>p1 0.0025 mol·L-1·h-1 0.53
【解析】
(1)根据表格数据,溶液的pH=5,c(S2-)=1.4×10-11molL-1,Mn2+开始沉淀,结合Ksp=c(Mn2+)c(S2-)计算;
(2)①2H2S(g)![]() 2H2(g)+S2(g)为气体体积增大的反应,根据压强对平衡的影响结合图像分析判断;②950℃时,压强为p3,H2S的转化率为30%,计算出H2S的物质的量的变化量,计算v(H2S),再根据方程式计算v(S2);③压强p2=7.2 MPa、温度为975 ℃时,H2S的转化率为40%,根据三段式计算。
2H2(g)+S2(g)为气体体积增大的反应,根据压强对平衡的影响结合图像分析判断;②950℃时,压强为p3,H2S的转化率为30%,计算出H2S的物质的量的变化量,计算v(H2S),再根据方程式计算v(S2);③压强p2=7.2 MPa、温度为975 ℃时,H2S的转化率为40%,根据三段式计算。
(1)根据表格数据,溶液的pH=5,c(S2-)=1.4×10-11molL-1,Mn2+开始沉淀,所以Ksp=c(Mn2+)c(S2-)=1.4×10-11molL-1×0.020molL-1=2.8×10-13,故答案为:2.8×10-13;
(2)①2H2S(g)![]() 2H2(g)+S2(g)为气体体积增大的反应,压强越大,H2S的转化率越低,因此压强p1、p2、p3由大到小的顺序为p3>p2>p1,故答案为:p3>p2>p1;
2H2(g)+S2(g)为气体体积增大的反应,压强越大,H2S的转化率越低,因此压强p1、p2、p3由大到小的顺序为p3>p2>p1,故答案为:p3>p2>p1;
②950℃时,压强为p3,H2S的转化率为30%,H2S的物质的量的变化量△n=0.1mol×30%=0.03mol,因此v(H2S)=![]() =
= =0.005mol/(Lh),则v(S2)=
=0.005mol/(Lh),则v(S2)=![]() v(H2S)=0.0025mol/(Lh), 故答案为:0.0025mol/(Lh);
v(H2S)=0.0025mol/(Lh), 故答案为:0.0025mol/(Lh);
③压强p2=7.2 MPa、温度为975 ℃时,H2S的转化率为40%,H2S的物质的量的变化量为0.1mol×40%=0.04mol,
2H2S(g)![]() 2H2(g)+S2(g)
2H2(g)+S2(g)
起始量(mol)0.1 0 0
变化量(mol)0.04 0.04 0.02
平衡量(mol)0.06 0.04 0.02
平衡常数Kp= =0.53 MPa,故答案为:0.53 MPa。
=0.53 MPa,故答案为:0.53 MPa。

【题目】将0.48g镁粉分别加入10.0mL下列溶液,反应6小时,用排水法收集产生的气体,溶液组成与H2体积(已换算成标准状况)的关系如下表。下列说法不正确的是
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
溶液组成 | H2O | 1.0mol/L NH4Cl | 0.1mol/L NH4Cl | 1.0mol/L NaCl | 1.0mol/L NaNO3 | 0.8mol/L NH4Cl+ 0.2mol/L NH3·H2O | 0.2mol/L NH4Cl+ 0.8mol/L NH3·H2O |
V/ml | 12 | 433 | 347 | 160 | 14 | 401 | 349 |
A.由实验2、3可得,![]() 浓度越大,镁和水反应速率越快
浓度越大,镁和水反应速率越快
B.由实验1、4、5可得,Cl-对镁和水的反应有催化作用
C.由实验3、7可得,反应过程产生的Mg(OH)2覆盖在镁表面,减慢反应
D.无论酸性条件还是碱性条件,![]() 都能加快镁和水的反应
都能加快镁和水的反应