题目内容
【题目】(1)元素C、N、O、K的电负性从大到小依次为______。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为______。
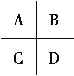
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是______(填“A”“B”“C”或“D”)。
(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为______;B和N相比,电负性较大的是______,BN中B元素的化合价为______。
【答案】O>N>C>K C>H>Si D 1s22s22p1 N +3价
【解析】
本题主要考察元素的性质。
(1)电负性是元素的原子在化合物中吸引电子的能力的标度。元素的电负性越大,表示其原子在化合物中吸引电子的能力越强。C、N、O、K的吸引电子的能力大小为O>N>C>K,则其电负性大小为:O>N>C>K;
(2)CH4中共用电子对偏向C,说明C对电子的吸引能力大于H;SiH4中共用电子对偏向H,则说明H对电子的吸引能力大于Si;所以这三个元素的电负性比较为:C>H>Si;
(3)A的单质是空气中含量最多的物质,则A为N,根据周期表的位置可以推出,B为O,C为P,D为S;第一电离能是基态的气态原子失去最外层的一个电子所需能量。第一电离能数值越小,原子越容易失去一个电子;第一电离能数值越大,原子越难失去一个电子。S的第一电离能最小,故合理选项为D;
(4)B是5号元素,则其基态原子的核外电子排布式为1s22s22p1;N的非金属性比B大,则其对电子的吸引能力更大,所以N的电负性较大;B位于III A族,所以其化合价为+3价。

【题目】将0.48g镁粉分别加入10.0mL下列溶液,反应6小时,用排水法收集产生的气体,溶液组成与H2体积(已换算成标准状况)的关系如下表。下列说法不正确的是
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
溶液组成 | H2O | 1.0mol/L NH4Cl | 0.1mol/L NH4Cl | 1.0mol/L NaCl | 1.0mol/L NaNO3 | 0.8mol/L NH4Cl+ 0.2mol/L NH3·H2O | 0.2mol/L NH4Cl+ 0.8mol/L NH3·H2O |
V/ml | 12 | 433 | 347 | 160 | 14 | 401 | 349 |
A.由实验2、3可得,![]() 浓度越大,镁和水反应速率越快
浓度越大,镁和水反应速率越快
B.由实验1、4、5可得,Cl-对镁和水的反应有催化作用
C.由实验3、7可得,反应过程产生的Mg(OH)2覆盖在镁表面,减慢反应
D.无论酸性条件还是碱性条件,![]() 都能加快镁和水的反应
都能加快镁和水的反应