题目内容
【题目】写出下列物质的电子式:
(1)CaCl2:___;Na2S:___;HCl:___。
写出下列物质的结构式:
(2)HClO:___;CO2:___;N2:___。
写出下列物质的结构示意图:
(3)Ca:___;Mg2+:___;F-:___。
【答案】![]()
![]()
![]() H-O-Cl O=C=O N≡N
H-O-Cl O=C=O N≡N 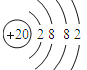
![]()
![]()
【解析】
(1)CaCl2是离子化合物,Ca2+与Cl-之间通过离子键结合;Na2S是离子化合物,Na+与S2-之间通过离子键结合;HCl是共价化合物,H原子与Cl原子之间通过共价键结合;
(2)HClO中O原子分别与H原子、Cl原子各形成1个共价键;CO2中C原子与2个O原子分别形成2个共价键;N2中2个N原子形成3个共价键;
(3)Ca是20号元素,根据原子核外电子排布规律书写其原子结构示意图;Mg2+是Mg原子失去最外层2个电子形成的阳离子;F-是F原子获得1个电子形成的阴离子。
(1)CaCl2是离子化合物,Ca2+与2个Cl-之间通过离子键结合,电子式为:![]() ;
;
Na2S是离子化合物,2个Na+与S2-之间通过离子键结合,电子式为:![]() ;
;
HCl是共价化合物,H原子与Cl原子之间通过1个共价键结合,电子式为:![]() ;
;
(2)在HClO分子中,O原子分别与H原子、Cl原子各形成1个共价键,使分子中H原子达到最外层2个电子的稳定结构,O原子和Cl原子达到最外层8个电子的稳定结构,其结构式是H-O-Cl;
在CO2分子中,C原子与2个O原子分别形成2个共价键,从而使分子中每个原子都达到最外层8个电子的稳定结构,其结构式是:O=C=O;
N2分子中2个N原子形成3个共价键,使分子中2个N原子都达到最外层8个电子的稳定结构,其结构式是:N≡N;
(3)Ca是20号元素,原子核外电子排布为2、8、8、2,所以其原子结构示意图为: ;Mg是12号元素,原子核外电子排布为2、8、2,Mg2+是Mg原子失去最外层2个电子形成的阳离子,因此其离子结构示意图为:
;Mg是12号元素,原子核外电子排布为2、8、2,Mg2+是Mg原子失去最外层2个电子形成的阳离子,因此其离子结构示意图为:![]() ;
;
F是9号元素,原子核外电子排布为2、7,F-是F原子获得1个电子形成的阴离子,离子结构示意图为:![]() 。
。