题目内容
【题目】下列变化①碘的升华②烧碱熔化③氯化钠溶于水④氯化氢溶于水⑤氧气溶于水⑥氯化铵受热分解。
氯化铵的电子式是______________;未发生化学键破坏的是______________(填序号,下同);仅发生离子键破坏的是______________;仅发生共价键破坏的是______________;既发生离子键又发生共价键破坏的是______________。
【答案】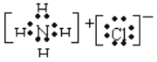 ①⑤ ②③ ④ ⑥
①⑤ ②③ ④ ⑥
【解析】
氯化铵是离子化合物,故其电子式是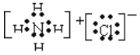 ;①碘的升华和⑤氧气溶于水,仅仅改变了分子间作用力,并未破坏发生化学键;②烧碱熔化和③氯化钠溶于水使二者发生电离,故仅破坏了离子键;④氯化氢溶于水也是发生电离,因为氯化氢是共价化合物,故仅破坏了共价键;⑥氯化铵受热分解是化学变化,且氯化铵既有离子键又有共价键,故氯化铵受热分解既破坏了离子键又破坏了共价键,故答案为:
;①碘的升华和⑤氧气溶于水,仅仅改变了分子间作用力,并未破坏发生化学键;②烧碱熔化和③氯化钠溶于水使二者发生电离,故仅破坏了离子键;④氯化氢溶于水也是发生电离,因为氯化氢是共价化合物,故仅破坏了共价键;⑥氯化铵受热分解是化学变化,且氯化铵既有离子键又有共价键,故氯化铵受热分解既破坏了离子键又破坏了共价键,故答案为:![]() ①⑤ ②③
①⑤ ②③
④ ⑥。

练习册系列答案
相关题目