题目内容
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH________11(填“>”“=”或“<”)原因是______________________________________________(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH________NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(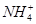 )由大到小的顺序为________;
)由大到小的顺序为________;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH)=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
(5)NaHSO4在水中的电离方程式为NaHSO4=Na++H++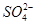 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(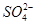 )(填“>”“=”或“<”)。
)(填“>”“=”或“<”)。
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(
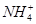 )由大到小的顺序为________;
)由大到小的顺序为________;(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH)=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
(5)NaHSO4在水中的电离方程式为NaHSO4=Na++H++
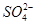 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(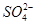 )(填“>”“=”或“<”)。
)(填“>”“=”或“<”)。(1)> 加水稀释使平衡CH3COO-+H2O CH3COOH+OH-右移 >
CH3COOH+OH-右移 >
(2)①=②>③ (3)碱 > 酸 < (4)中 < (5)=
 CH3COOH+OH-右移 >
CH3COOH+OH-右移 >(2)①=②>③ (3)碱 > 酸 < (4)中 < (5)=
(1)首先写出CH3COO-+H2O CH3COOH+OH-,加水稀释,假设平衡不移动,那么c(OH-)=10-1mol·L-1÷100=10-3mol·L-1,但平衡右移,c(OH-)应比10-3mol·L-1大,所以最终溶液中c(OH-)>10-3mol·L-1;加热促进了CH3COO-的水解,使c(OH-)增大;(2)依据NH+H2O
CH3COOH+OH-,加水稀释,假设平衡不移动,那么c(OH-)=10-1mol·L-1÷100=10-3mol·L-1,但平衡右移,c(OH-)应比10-3mol·L-1大,所以最终溶液中c(OH-)>10-3mol·L-1;加热促进了CH3COO-的水解,使c(OH-)增大;(2)依据NH+H2O NH3·H2O+H+,因为①、②中的H+全部是水解生成的,且c(H+)相同,所以①=②;由NH4HSO4=
NH3·H2O+H+,因为①、②中的H+全部是水解生成的,且c(H+)相同,所以①=②;由NH4HSO4=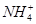 +H++
+H++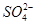 可知③中的H+大部分是电离生成的,所以c(NH4HSO4)远远小于c(NH4Cl);(3)正好完全中和生成CH3COONa,CH3COO-水解,显碱性;混合后溶液中含有CH3COONa、CH3COOH,显酸性,溶液中存在CH3COONa=CH3COO-+Na+、CH3COO-+H2O
可知③中的H+大部分是电离生成的,所以c(NH4HSO4)远远小于c(NH4Cl);(3)正好完全中和生成CH3COONa,CH3COO-水解,显碱性;混合后溶液中含有CH3COONa、CH3COOH,显酸性,溶液中存在CH3COONa=CH3COO-+Na+、CH3COO-+H2O CH3COOH+OH-、CH3COOH
CH3COOH+OH-、CH3COOH CH3COO-+H+、H2O
CH3COO-+H+、H2O OH-+H+,CH3COOH的电离程度大于CH3COO-的水解程度,所以电离生成的CH3COO-大于水解消耗的CH3COO-,即c(Na+)<c(CH3COO-);我们也可以用电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+)求解,因为混合后溶液呈酸性,所以c(H+)>c(OH-),所以c(Na+)<c(CH3COO-);(4)由电荷守恒c(OH-)+c(Cl-)=c(H+)+c(
OH-+H+,CH3COOH的电离程度大于CH3COO-的水解程度,所以电离生成的CH3COO-大于水解消耗的CH3COO-,即c(Na+)<c(CH3COO-);我们也可以用电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+)求解,因为混合后溶液呈酸性,所以c(H+)>c(OH-),所以c(Na+)<c(CH3COO-);(4)由电荷守恒c(OH-)+c(Cl-)=c(H+)+c(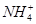 )即可求解;(5)由电荷守恒c(OH-)+2c(
)即可求解;(5)由电荷守恒c(OH-)+2c(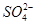 )=c(H+)+c(Na+)、物料守恒c(
)=c(H+)+c(Na+)、物料守恒c(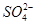 )=c(Na+)两式组合即可求解。
)=c(Na+)两式组合即可求解。
 CH3COOH+OH-,加水稀释,假设平衡不移动,那么c(OH-)=10-1mol·L-1÷100=10-3mol·L-1,但平衡右移,c(OH-)应比10-3mol·L-1大,所以最终溶液中c(OH-)>10-3mol·L-1;加热促进了CH3COO-的水解,使c(OH-)增大;(2)依据NH+H2O
CH3COOH+OH-,加水稀释,假设平衡不移动,那么c(OH-)=10-1mol·L-1÷100=10-3mol·L-1,但平衡右移,c(OH-)应比10-3mol·L-1大,所以最终溶液中c(OH-)>10-3mol·L-1;加热促进了CH3COO-的水解,使c(OH-)增大;(2)依据NH+H2O NH3·H2O+H+,因为①、②中的H+全部是水解生成的,且c(H+)相同,所以①=②;由NH4HSO4=
NH3·H2O+H+,因为①、②中的H+全部是水解生成的,且c(H+)相同,所以①=②;由NH4HSO4=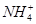 +H++
+H++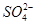 可知③中的H+大部分是电离生成的,所以c(NH4HSO4)远远小于c(NH4Cl);(3)正好完全中和生成CH3COONa,CH3COO-水解,显碱性;混合后溶液中含有CH3COONa、CH3COOH,显酸性,溶液中存在CH3COONa=CH3COO-+Na+、CH3COO-+H2O
可知③中的H+大部分是电离生成的,所以c(NH4HSO4)远远小于c(NH4Cl);(3)正好完全中和生成CH3COONa,CH3COO-水解,显碱性;混合后溶液中含有CH3COONa、CH3COOH,显酸性,溶液中存在CH3COONa=CH3COO-+Na+、CH3COO-+H2O CH3COOH+OH-、CH3COOH
CH3COOH+OH-、CH3COOH CH3COO-+H+、H2O
CH3COO-+H+、H2O OH-+H+,CH3COOH的电离程度大于CH3COO-的水解程度,所以电离生成的CH3COO-大于水解消耗的CH3COO-,即c(Na+)<c(CH3COO-);我们也可以用电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+)求解,因为混合后溶液呈酸性,所以c(H+)>c(OH-),所以c(Na+)<c(CH3COO-);(4)由电荷守恒c(OH-)+c(Cl-)=c(H+)+c(
OH-+H+,CH3COOH的电离程度大于CH3COO-的水解程度,所以电离生成的CH3COO-大于水解消耗的CH3COO-,即c(Na+)<c(CH3COO-);我们也可以用电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+)求解,因为混合后溶液呈酸性,所以c(H+)>c(OH-),所以c(Na+)<c(CH3COO-);(4)由电荷守恒c(OH-)+c(Cl-)=c(H+)+c(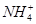 )即可求解;(5)由电荷守恒c(OH-)+2c(
)即可求解;(5)由电荷守恒c(OH-)+2c(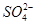 )=c(H+)+c(Na+)、物料守恒c(
)=c(H+)+c(Na+)、物料守恒c(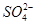 )=c(Na+)两式组合即可求解。
)=c(Na+)两式组合即可求解。
练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
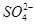 、
、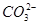 、
、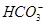 、
、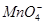 。
。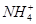 。
。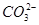 、
、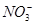 、
、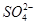 、
、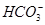 、
、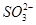 中的若干种离子。某同学对该溶液进行如下实验:
中的若干种离子。某同学对该溶液进行如下实验: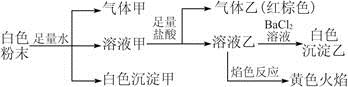
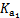 =4.3×10-7
=4.3×10-7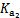 =5.6×10-11
=5.6×10-11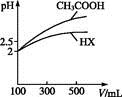
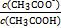 = 。
= 。