题目内容
有一种白色粉末,含有下列阴离子和阳离子中的几种。
阴离子:S2-、Cl-、NO、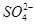 、
、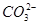 、
、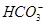 、
、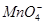 。
。
阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、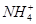 。
。
将该白色粉末进行下列实验,观察到的现象如下:
根据实验推断:
(1)从a实验中,可推断粉末中不可能有 (填离子符号,下同)。
(2)从b实验中,可推断粉末中不可能有 。
(3)从c实验中,可推断粉末中不可能有 。
(4)从d实验中,可推断粉末中不可能有 ,一定含有 。
(5)以上各实验仍无法确定是否存在的离子是 。
阴离子:S2-、Cl-、NO、
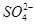 、
、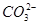 、
、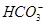 、
、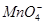 。
。阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、
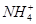 。
。将该白色粉末进行下列实验,观察到的现象如下:
| 实验操作 | 现象 |
| a.取少量粉末,加水、振荡 | 全部溶解、 |
| 溶液无色透明 | |
| b.向所得溶液中慢慢滴入苛性钠溶液,并加热 | 无明显现象 |
| c.取少量粉末,加盐酸 | 无明显现象 |
| d.取少量粉末,加稀H2SO4和稀HNO3的混合液 | 有白色沉淀生成 |
(1)从a实验中,可推断粉末中不可能有 (填离子符号,下同)。
(2)从b实验中,可推断粉末中不可能有 。
(3)从c实验中,可推断粉末中不可能有 。
(4)从d实验中,可推断粉末中不可能有 ,一定含有 。
(5)以上各实验仍无法确定是否存在的离子是 。
(1)Fe2+、Fe3+、Cu2+、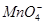
(2)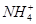 、Mg2+、Al3+
、Mg2+、Al3+
(3)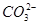 、
、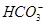 、S2-
、S2-
(4)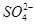 Ba2+
Ba2+
(5)Cl-、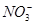 、Na+
、Na+
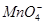
(2)
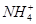 、Mg2+、Al3+
、Mg2+、Al3+(3)
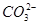 、
、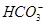 、S2-
、S2-(4)
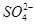 Ba2+
Ba2+(5)Cl-、
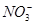 、Na+
、Na+(1)Fe3+为棕黄色,Fe2+为浅绿色,Cu2+为蓝色,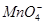 为紫色。
为紫色。
(2)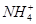 与OH-可反应生成NH3,Mg2+、Al3+可与OH-反应生成沉淀。
与OH-可反应生成NH3,Mg2+、Al3+可与OH-反应生成沉淀。
(3)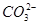 、
、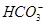 可分别与H+反应生成CO2气体。
可分别与H+反应生成CO2气体。
(4)加入硫酸和硝酸生成的沉淀只能是BaSO4,因此可推出含有Ba2+,则必不含有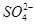 。
。
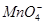 为紫色。
为紫色。(2)
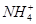 与OH-可反应生成NH3,Mg2+、Al3+可与OH-反应生成沉淀。
与OH-可反应生成NH3,Mg2+、Al3+可与OH-反应生成沉淀。(3)
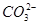 、
、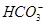 可分别与H+反应生成CO2气体。
可分别与H+反应生成CO2气体。(4)加入硫酸和硝酸生成的沉淀只能是BaSO4,因此可推出含有Ba2+,则必不含有
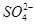 。
。
练习册系列答案
相关题目
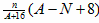 N A
N A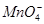 、
、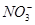 、Na+
、Na+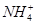 、
、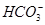 、
、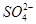 、
、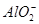
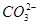 、
、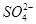 、
、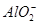 、
、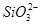 、
、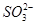
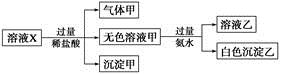
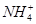 )由大到小的顺序为________;
)由大到小的顺序为________;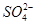 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(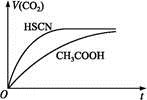
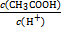
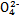 )(填“<”“>”或“=”)。
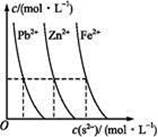
)(填“<”“>”或“=”)。 Ag+(aq)+Cl-(aq)在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号),此时溶液②中Cl-物质的量浓度为 。
Ag+(aq)+Cl-(aq)在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号),此时溶液②中Cl-物质的量浓度为 。