题目内容
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO
d.NaHCO3;pH由小到大的排列顺序是 (用字母表示)。
(2)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(填序号)。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
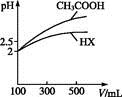
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。理由是 。
(4)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确值),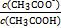 = 。
= 。
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | 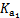 =4.3×10-7 =4.3×10-7 | 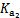 =5.6×10-11 =5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO
d.NaHCO3;pH由小到大的排列顺序是 (用字母表示)。
(2)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(填序号)。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。理由是 。

(4)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确值),
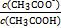 = 。
= 。 (1)adcb (2)BD (3)小于 稀释相同倍数,一元酸HX的pH变化比CH3COOH小,故酸性弱,电离平衡常数小 (4)9.9×10-7 18
(1)观察电离平衡常数可知酸性为CH3COOH>H2CO3>HClO>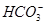 ,依据越弱越水解,所以得出pH大小顺序为a<d<c<b;(2)稀释溶液中除了c(OH-)增大外,其余均减小,D选项符合;假设平衡不移动,则
,依据越弱越水解,所以得出pH大小顺序为a<d<c<b;(2)稀释溶液中除了c(OH-)增大外,其余均减小,D选项符合;假设平衡不移动,则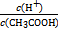 不变,但CH3COOH
不变,但CH3COOH CH3COO-+H+右移,B选项符合;C选项是水的离子积常数,不变。(4)根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7;由Ka=
CH3COO-+H+右移,B选项符合;C选项是水的离子积常数,不变。(4)根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7;由Ka=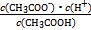 =1.8×10-5可知
=1.8×10-5可知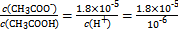 。
。
 ,依据越弱越水解,所以得出pH大小顺序为a<d<c<b;(2)稀释溶液中除了c(OH-)增大外,其余均减小,D选项符合;假设平衡不移动,则
,依据越弱越水解,所以得出pH大小顺序为a<d<c<b;(2)稀释溶液中除了c(OH-)增大外,其余均减小,D选项符合;假设平衡不移动,则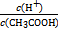 不变,但CH3COOH
不变,但CH3COOH CH3COO-+H+右移,B选项符合;C选项是水的离子积常数,不变。(4)根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7;由Ka=
CH3COO-+H+右移,B选项符合;C选项是水的离子积常数,不变。(4)根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7;由Ka=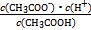 =1.8×10-5可知
=1.8×10-5可知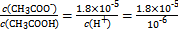 。
。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
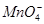 、
、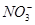 、Na+
、Na+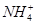 、
、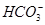 、
、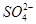 、
、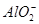
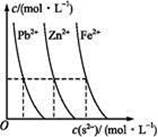
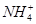 )由大到小的顺序为________;
)由大到小的顺序为________;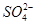 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(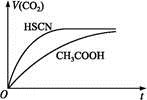
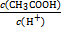
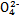 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。