题目内容
下列有关判断正确的是( )
| A.0.1mol/LNa2CO3溶液:c(OH-)= 2c(H2CO3)+ c(HCO3-)+ c(H+) |
| B.能使紫色石蕊试液呈红色的溶液:Na+、NH、I-、NO可以大量共存 |
| C.任何条件下,pH=13的氢氧化钠溶液中:c(OH-)=0.1mol/L |
| D.NH4HCO3溶于过量的NaOH溶液中:HCO3-+ OH-= CO32- + H2O |
A
试题分析:A.0.1mol/LNa2CO3溶液:c(OH-)= 2c(H2CO3)+ c(HCO3-)+ c(H+)符合质子守恒。正确。B.能使紫色石蕊试液呈红色的溶液是酸性溶液。此时会发生反应:8H++6I-+2NO=3I2+2NO↑+ 4H2O不能大量共存。错误。C.在室温下 pH=13的氢氧化钠溶液中:c(OH-)=Kw÷c(H+)=10-14÷10-13=0.1mol/L.水的电量是吸热过程。若是升高温度,则促进水的电离,Kw增大。c(OH-)>0.1mol/L。错误。D.NH4HCO3溶于过量的NaOH溶液中发生反应:HCO3-+ NH4++ 2OH-= CO32- + 2H2O+NH3↑。错误。

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
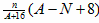 N A
N A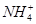 )由大到小的顺序为________;
)由大到小的顺序为________;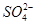 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(
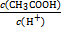
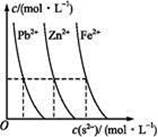
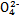 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。 Ag+(aq)+Cl-(aq)在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号),此时溶液②中Cl-物质的量浓度为 。
Ag+(aq)+Cl-(aq)在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号),此时溶液②中Cl-物质的量浓度为 。