题目内容
某温度下,已知反应mX(g)+nY(g) 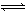 qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
| A.若将容器体积变为原来一半,c(Z)为原来的1.8倍,则m+n<q |
| B.该反应达到平衡时,加入Y,该反应的ΔH改变增大 |
| C.升高温度,c(Y)/c(Z)的值减小 |
| D.使用催化剂,就可反应完全 |
A
解析试题分析:A、将容器体积变为原来一半的瞬间Z的浓度是原来的2倍,但最终平衡时c(Z)为原来的1.8倍,这说明增大压强平衡向逆反应方向移动,所以正方应是体积增大的,即m+n<q,A正确;B、反应热只与反应物与生成物总能量的相对大小有关系,与平衡移动无关,因此该反应达到平衡时,加入Y,该反应的ΔH不变,B不正确;C、正方应是放热反应,则升高温度平衡向逆反应方向移动,所以升高温度,c(Y)/c(Z)的值增大,C不正确;D、催化剂只能改变反应速率,而不能改变平衡状态,所以使用催化剂,反应液不可能反应完全,D不正确,答案选A。
考点:考查外界条件对反应速率和平衡状态的影响以及反应热的有关判断

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案工业上常用可逆反应2SO2+O2 2SO3△H<0,制备硫酸,下列对该反应的说法正确的是
2SO3△H<0,制备硫酸,下列对该反应的说法正确的是
| A.增大压强,平衡向逆反应方向移动 |
| B.升高温度,平衡向正反应方向移动 |
| C.当v(SO2):v(O2):v(SO3 )=2:1:2时,反应达到平衡状态 |
| D.当单位时间内生成2 mol SO2的同时生成2 mol SO3,说明该反应达到平衡状态 |
某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) Z(g)+W(s) ΔH>0,下列叙述正确的是
Z(g)+W(s) ΔH>0,下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.当容器中气体压强不变时,反应达到平衡 |
| C.升高温度,平衡逆向移动 |
| D.平衡后加入X,上述反应的ΔH增大 |
在300℃时,改变起始反应物中n(H2)对反应N2(g) + 3H2(g)  2NH3(g)+Q(Q>0)的影响如右图所示。下列说法正确的是
2NH3(g)+Q(Q>0)的影响如右图所示。下列说法正确的是
| A.反应在b点达到平衡 |
| B.b点H2的转化率最高 |
| C.c点N2的转化率最高 |
| D.a、b、c三点的平衡常数Kb > Ka > Kc |
已知:CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41kJ/mol相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡过程体系 | |||
| CO | H2O | CO2 | H2 | 能量的变化 | |
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器②中吸收的热量O为32.8 kJ
C.平衡时,两容器中CO2的浓度相等
D.容器①中当CO反应速率等于H2O的反应速率时,反应可能达到平衡
在密闭容器中存在如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g) ΔH<0,某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( ) 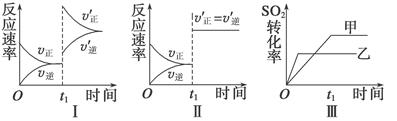
| A.图Ⅰ表示的是t1时刻增大压强对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g) 2CO2(g)+S(l) ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是 ( )
2CO2(g)+S(l) ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是 ( )
| A.平衡前,随着反应的进行,容器内压强始终不变 |
| B.平衡时,其他条件不变,分离出硫,正反应速率加快 |
| C.平衡时,其他条件不变,升高温度可提高SO2的转化率 |
| D.其他条件不变,使用不同催化剂,该反应的平衡常数不变 |
 C+B(反应物、产物均为气体)平衡后测知各物质浓度有如下关系:{c(A)}a·c(B)=c(C)·c(D)然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则这时B的转化率是
C+B(反应物、产物均为气体)平衡后测知各物质浓度有如下关系:{c(A)}a·c(B)=c(C)·c(D)然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则这时B的转化率是