题目内容
t℃时,在一密闭容器中充入2mol A和3mol B,发生如下化学反应:aA+B C+B(反应物、产物均为气体)平衡后测知各物质浓度有如下关系:{c(A)}a·c(B)=c(C)·c(D)然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则这时B的转化率是
C+B(反应物、产物均为气体)平衡后测知各物质浓度有如下关系:{c(A)}a·c(B)=c(C)·c(D)然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则这时B的转化率是
A.60% B.40% C.50% D.无法确定
B
解析试题分析:平衡后测知各物质浓度有如下关系:{c(A)}a·c(B)=c(C)·c(D),则根据平衡常数表达式K=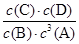 可知,K=1。在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,这说明平衡不变,因此反应前后体积不变,则a=1,所以
可知,K=1。在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,这说明平衡不变,因此反应前后体积不变,则a=1,所以
A + B C + B
C + B
起始量(mol) 2 3 0 0
转化量(mol)x x x x
平衡量(mol)2-x 3-x x x
由于反应前后体积不变,所以可以用物质的量代替浓度进行平衡常数计算
则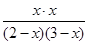 =1
=1
解得x=1.2
所以B的转化率= ×100%=40%,答案选B。
×100%=40%,答案选B。
考点:考查平衡常数、转化率的计算

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案一定条件下反应2AB(g) A2(g) +B2(g),不能确定达到平衡状态的是
A2(g) +B2(g),不能确定达到平衡状态的是
| A.单位时间内生成n mol A2,同时生成2n molAB |
| B.单位时间内生成n mol B2,同时生成2n molAB |
| C.AB的消耗速率等于A2的消耗速率 |
| D.容器中各组分的物质的量分数不随时间变化 |
升高温度,下列数据不一定增大的是
A.化学反应速率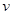 | B.KNO3的溶解度S |
| C.化学平衡常数K | D.水的离子积常数Kw |
将NO2装入带活塞的密闭容器中,当反应2NO2(g) N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是()
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是()
| A.升高温度,气体颜色加深,则此反应为吸热反应 |
| B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅 |
| C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 |
| D.恒温恒容时,充入少量惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅 |
一定条件下,可逆反应C(s)+CO2(g) 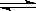 2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
| A.①②③④ | B.①③ | C.②④ | D.①③④ |
某温度下,已知反应mX(g)+nY(g) 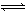 qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
| A.若将容器体积变为原来一半,c(Z)为原来的1.8倍,则m+n<q |
| B.该反应达到平衡时,加入Y,该反应的ΔH改变增大 |
| C.升高温度,c(Y)/c(Z)的值减小 |
| D.使用催化剂,就可反应完全 |
某温度下,反应X(g)+3Y(g) 2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
下列说法正确的是( )
| A.此时v(正)<v(逆) |
| B.平衡时Y的浓度为0.05 mol·L-1 |
| C.平衡时X的转化率为40% |
| D.增大压强使平衡向正反应方向移动,平衡常数增大 |
 2C(g) △H<0,下列各图中正确的是
2C(g) △H<0,下列各图中正确的是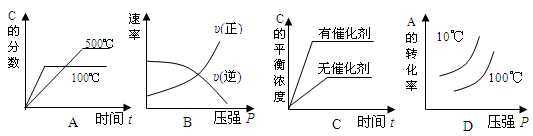

 2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol有关反应速率中正确的是 ( )
2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol有关反应速率中正确的是 ( )