题目内容
工业上常用可逆反应2SO2+O2 2SO3△H<0,制备硫酸,下列对该反应的说法正确的是
2SO3△H<0,制备硫酸,下列对该反应的说法正确的是
| A.增大压强,平衡向逆反应方向移动 |
| B.升高温度,平衡向正反应方向移动 |
| C.当v(SO2):v(O2):v(SO3 )=2:1:2时,反应达到平衡状态 |
| D.当单位时间内生成2 mol SO2的同时生成2 mol SO3,说明该反应达到平衡状态 |
D
解析试题分析:A、根据方程式可知,该反应是体积减小的,因此增大压强,平衡正反应方向移动,A不正确;B、正方应是放热反应,则升高温度平衡向逆反应方向移动,所以B不正确;C、在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。由于反应速率之比是化学计量数之比,因此v(SO2):v(O2):v(SO3 )=2:1:2恒成立,不能说明反应达到平衡状态,C不正确;D、当单位时间内生成2 mol SO2的同时必然消耗2mol三氧化硫,由于同时生成2 mol SO3,即正逆反应速率相等,所以说明该反应达到平衡状态,D正确,答案选D。
考点:考查外界条件对平衡状态的影响、平衡状态的判断

练习册系列答案
相关题目
一定条件下,可逆反应C(s)+CO2(g) 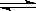 2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
| A.①②③④ | B.①③ | C.②④ | D.①③④ |
下列表述与示意图相符的是
| A.正反应为吸热反应 |
| B.升高温度,有利于反应向正方向进行 |
| C.A点时,反应向逆反应方向移动 |
| D.K正与K逆的关系是:K正=1/K逆 |
已知:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,下列各组实验中,反应速率最快的是
| 组号 | 反应温 度/℃ | Na2S2O3 | H2SO4 | H2O体积/mL | ||
| 体积/mL | 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | |||
| A | 10 | 5 | 0.2 | 5 | 0.1 | 10 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
某温度下,已知反应mX(g)+nY(g) 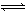 qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
| A.若将容器体积变为原来一半,c(Z)为原来的1.8倍,则m+n<q |
| B.该反应达到平衡时,加入Y,该反应的ΔH改变增大 |
| C.升高温度,c(Y)/c(Z)的值减小 |
| D.使用催化剂,就可反应完全 |
C+CO2 2CO △H 1>0,反应速率v1 ,N2+3H2
2CO △H 1>0,反应速率v1 ,N2+3H2 2NH3 △H 2<0,反应速率v2 。若升高温度,v1和v2的变化是
2NH3 △H 2<0,反应速率v2 。若升高温度,v1和v2的变化是
| A.同时增大 | B.同时减少 | C.v1增大,v2减少 | D.v1减少,v2增大 |
 2C(g) △H<0,下列各图中正确的是
2C(g) △H<0,下列各图中正确的是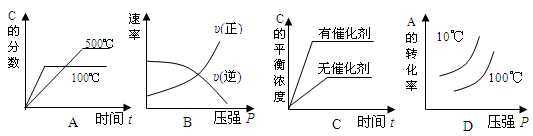

 2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol有关反应速率中正确的是 ( )
2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol有关反应速率中正确的是 ( ) 3C(g)的下列叙述中,能说明反应已达到平衡的是
3C(g)的下列叙述中,能说明反应已达到平衡的是