��Ŀ����
��֪��CO(g)+H2O(g)=CO2(g)+H2(g)��H=��41kJ/mol��ͬ�¶��£��������ͬ�����������ܱ������У�����һ�����ķ�Ӧ�����Ӧ������������£�
| ���� ��� | ��ʼʱ���������ʵ�����mol | ��ƽ�������ϵ | |||
| CO | H2O | CO2 | H2 | �����ı仯 | |
| �� | 1 | 4 | 0 | 0 | �ų�������32.8 kJ |
| �� | 0 | 0 | 1 | 4 | �����仯��Q |
����˵���У�����ȷ���ǣ� ��
A���������з�Ӧ��ƽ��ʱ��CO��ת����Ϊ80��
B�������������յ�����OΪ32.8 kJ
C��ƽ��ʱ����������CO2��Ũ�����
D���������е�CO��Ӧ���ʵ���H2O�ķ�Ӧ����ʱ����Ӧ���ܴﵽƽ��
C
�������������������֪����ʽ��֪��1molCO��ȫ��Ӧ�ų�41kJ�������������ٷų�32.8 kJ����������ת����Ϊ32.8 kJ��41kJ=0.8������A��ȷ�����ݷ�Ӧ����ʽ������ϵ����ȵ��ص㣬�����ڵ�CO2�����������������CO��ͬ����������ͬ�����·�Ӧ����������µ�ת������ȣ���Ϊ����ӦΪ���ȷ�Ӧ�������淴ӦӦΪ���ȣ�ͬ������32.8 kJ������B��ȷ������2�����к�C���ʵ�ת������ͬ������CO2��Ũ�Ȳ���ȣ�C������ʽ�� CO��H2O�ķ�Ӧϵ����ȣ����Է�Ӧ������ȣ��ﵽƽ��ʱҲ��ȣ����Ե�CO��Ӧ���ʵ���H2O�ķ�Ӧ����ʱ��ӦҲ�п��ܴﵽƽ�⣬����D��ȷ����ѡC��

��֪��Na2S2O3��H2SO4=Na2SO4��SO2����S����H2O�����и���ʵ���У���Ӧ����������
| ��� | ��Ӧ�� ��/�� | Na2S2O3 | H2SO4 | H2O���/mL | ||
| ���/mL | Ũ��/mol��L��1 | ���/mL | Ũ��/mol��L��1 | |||
| A | 10 | 5 | 0.2 | 5 | 0.1 | 10 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
ij�¶��£���֪��ӦmX(g)+nY(g) 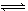 qZ(g) ��H��0����һ��������ܱ������дﵽƽ�⣬�����������䣬����������ȷ����
qZ(g) ��H��0����һ��������ܱ������дﵽƽ�⣬�����������䣬����������ȷ����
| A���������������Ϊԭ��һ�룬c(Z)Ϊԭ����1.8������m+n��q |
| B���÷�Ӧ�ﵽƽ��ʱ������Y���÷�Ӧ�Ħ�H�ı����� |
| C�������¶ȣ�c(Y)/c(Z)��ֵ��С |
| D��ʹ�ô������Ϳɷ�Ӧ��ȫ |
��������ܱ������о�����1mol X��1mol Y���ֱ�����300���500�濪ʼ������Ӧ��X(g)+Y(g) 3Z(g)��Z�ĺ�����Z%����ʱ��t�ı仯��ͼ��ʾ����֪��
3Z(g)��Z�ĺ�����Z%����ʱ��t�ı仯��ͼ��ʾ����֪�� ʱ�̸ı���ijһʵ�������������ж���ȷ����
ʱ�̸ı���ijһʵ�������������ж���ȷ����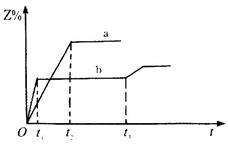
| A������a��500��ʱ��ͼ�� | B������Ӧ�����ȷ�Ӧ |
C�� ʱ�̿�����������ѹǿ ʱ�̿�����������ѹǿ | D�� ʱ�̿����ǽ������¶� ʱ�̿����ǽ������¶� |
�¶�ΪTʱ����2.0 L�����ܱ������г���1.0 mol PCl5����ӦPCl5(g) ��PCl3(g)��Cl2(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
����˵����ȷ����
A����Ӧ��ǰ50 s�ڵ�ƽ������v(PCl3)��0.0032 mol/(L��s)
B�����������������䣬�����¶ȣ�ƽ��ʱc(PCl3)��0.11 mol��L��1���÷�ӦΪ���ȷ�Ӧ
C����ͬ�¶��£���ʼʱ�������г���1.0 mol PCl5��0.20 mol PCl3��0.20 mol Cl2���ﵽƽ��ǰv(��)��v(��)
D����ͬ�¶��£���ʼʱ�������г��� 2.0 mol PCl3��2.0 mol Cl2���ﵽƽ��ʱ��PCl3��ת����С��80%
��һ�������£�����A2(g)+3B2(g) 2AB3(g)��Ӧ��˵����������ʾ�Ļ�ѧ��Ӧ������������
2AB3(g)��Ӧ��˵����������ʾ�Ļ�ѧ��Ӧ������������
| A��v(A2)��0.8mol��L-1��s-1 | B��v(A2)��40mol��L-1��min-1 |
| C��v(AB3)��1.0mol��L-1��s-1 | D��v(B2)��1.2mol��L-1��s-1 |
C+CO2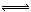 2CO ��H 1��0����Ӧ����v1 ��N2+3H2
2CO ��H 1��0����Ӧ����v1 ��N2+3H2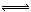 2NH3 ��H 2��0����Ӧ����v2 ���������¶ȣ�v1��v2�ı仯��
2NH3 ��H 2��0����Ӧ����v2 ���������¶ȣ�v1��v2�ı仯��
| A��ͬʱ���� | B��ͬʱ���� | C��v1����v2���� | D��v1���٣�v2���� |
ij���淴ӦaA + bB cC + Q��ij�¶��µ�ƽ�ⳣ��ΪK��K��1������Ӧ��ΪQ�������¶Ȳ��䣬������ʽ����д�����¸ı䣬��Q��K��ֵ����Ӧ�仯Ϊ( )
cC + Q��ij�¶��µ�ƽ�ⳣ��ΪK��K��1������Ӧ��ΪQ�������¶Ȳ��䣬������ʽ����д�����¸ı䣬��Q��K��ֵ����Ӧ�仯Ϊ( )
A��д��2aA + 2bB 2cC��Qֵ��Kֵ��������һ�� 2cC��Qֵ��Kֵ��������һ�� |
B��д��2aA + 2bB 2cC��Qֵ������һ����Kֵ���ֲ��� 2cC��Qֵ������һ����Kֵ���ֲ��� |
C��д��cC aA + bB��Qֵ��Kֵ��Ϊԭ�����෴�� aA + bB��Qֵ��Kֵ��Ϊԭ�����෴�� |
D��д��cC aA + bB��Qֵ��Ϊԭ�����෴����Kֵ��Ϊ���� aA + bB��Qֵ��Ϊԭ�����෴����Kֵ��Ϊ���� |

 2C(g)��2L�ܱ������з�Ӧ��0��5min��C�����ʵ���������0��6mol�йط�Ӧ��������ȷ���� �� ��
2C(g)��2L�ܱ������з�Ӧ��0��5min��C�����ʵ���������0��6mol�йط�Ӧ��������ȷ���� �� ��