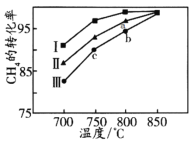
题目内容
【题目】钴蓝(化学式Al2CoO4)是一种耐热、耐光、耐酸、耐碱腐蚀的蓝色颜料。某企业利用含铝锂钴废料(铝箱、CoO和Co2O3、Li2O)制备钴蓝的工艺流程如下:
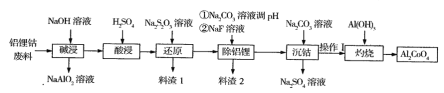
回答下列问题:
(1)碱浸时要有防火、防爆措施,原因是______,操作I的内容是_______。
(2)在实验室模拟工业生产时,也可用盐酸酸浸出钴,但实际工业生产中却不用盐酸,请 从反应原理分析不用盐酸浸出钴的主要原因___。
(3)写出“还原”过程中反应的离子方程式____。
(4)料渣2的主要成分是A1(OH)3 、____,写出灼烧时反应的化学方程式______。
【答案】Al与NaOH溶液反应时有可燃性气体生成 过滤、洗涤 Co2O3可氧化盐酸产生Cl2污染环境 8Co3++S2O32- +5H2O= 8Co2++2SO42- +10H+ LiF CoCO3+2Al(OH)3![]() Al2CoO4+CO2↑+3H2O
Al2CoO4+CO2↑+3H2O
【解析】
(1)碱浸时有氢气生成,氢气是一种可燃性气体;沉钴时得到CoCO3沉淀;
(2)盐酸具有还原性,能被Co2O3氧化生成有毒的氯气而污染环境;
(3)酸浸时Co2O3转化为Co2(SO4)3,还原时Co3+被Na2S2O3还原为Co2+;
(4)除铝锂时,A1转化为Al(OH)3, Li+转化为LiF。
(1)碱浸时有氢气生成,氢气是一种可燃性气体,故碱浸时要有防火、防爆措施;
沉钴时得到CoCO3沉淀,故操作I是过滤及洗涤;
(2)盐酸具有还原性,能被Co2O3氧化生成有毒的氯气而污染环境;
(3)酸浸时Co2O3转化为Co2(SO4)3,还原时Co3+被Na2S2O3还原为Co2+,离子方程式为8Co3++S2O32- +5H2O= 8Co2++2SO42- +10H+;
(4)除铝锂时,A1转化为Al(OH)3, Li+转化为LiF。 灼烧时,Al(OH)3 与CoCO3作用生成Al2CoO4, 另外有CO2、H2O生成,灼烧时反应的化学方程式为CoCO3+2Al(OH)3![]() Al2CoO4+CO2↑+3H2O。
Al2CoO4+CO2↑+3H2O。

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
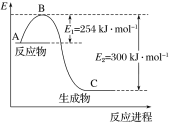
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。