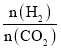题目内容
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2。在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
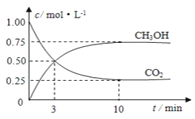
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=_____。
(2)500℃该反应的平衡常数为_____(结果保留一位小数)。
(3)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)____v(逆)(填“>”“<”或“=”)。
【答案】![]() 5.3
5.3 ![]()
【解析】
![]() 由图可知,10min到达平衡,平衡时甲醇的浓度变化为
由图可知,10min到达平衡,平衡时甲醇的浓度变化为![]() ,由方程式
,由方程式![]() 可知,氢气的浓度变化等于甲醇的浓度变化量的3倍,则氢气的浓度变化量为:
可知,氢气的浓度变化等于甲醇的浓度变化量的3倍,则氢气的浓度变化量为:![]() ,则
,则![]() ;故答案为:
;故答案为:![]() ;
;![]() 由
由![]() 可知平衡时各组分的浓度
可知平衡时各组分的浓度![]() ,
,![]() ,则
,则![]() ,所以
,所以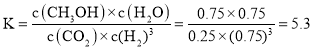 ,故答案为:
,故答案为:![]() ;
; ![]() 条件下,测得某时刻,
条件下,测得某时刻,![]() 、
、![]() 、
、![]() 和
和![]() 的浓度均为
的浓度均为![]() ,浓度熵
,浓度熵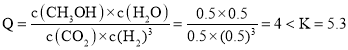 ,说明反应正向进行,v正
,说明反应正向进行,v正![]() v逆,故答案为:
v逆,故答案为:![]() 。
。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目