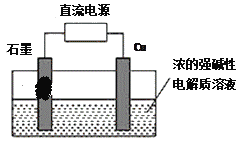
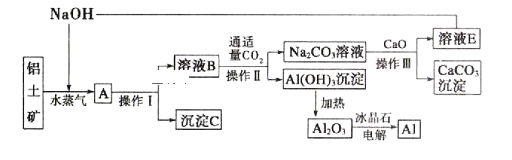
题目内容
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外, 曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_____。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4 蓝色溶液。
① [Ni(NH3)6]SO4中 H、N、O 元素的电负性由大到小的顺序为_____;SO42-的立体构型是_________;与 SO42-互为等电子体的微粒为_____(填化学式,任写一种)。
② 氨的沸点高于膦(PH3),原因是______; 氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为 。
(3)元素铜与镍的第二电离能分别为:ICu=1959kJ/mol ,INi=1753kJ/mol ,第二电离 ICu>INi 的原因是____________。
(4)铜的某种氯化物不仅易溶于水,而且易溶于乙醇和丙酮,其链状结构如图所示,则该氯化物的 化学式为____________________,属于_____晶体。

(5)Cu2+与乙二胺可形成上右图所示配离子,其中所含化学键类型有 ____(填标号)。
a.配位键 b.极性键 c.离子键 d.非极性键 e.金属键
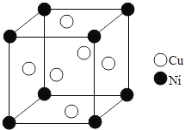
(6)某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为_____。
【答案】1s22s22p63s23p63d84s2 O>N>H 正四面体 CCl4 PO43-等 氨气分子之间形成氢键 极性 sp3 Cu+失去的是全充满的3d10电子,Ni+失去的是4s1电子,Cu+的核外电子排布更稳定,失去第二个电子更难,元素铜的第二电离能高于镍的; CuCl2 分子 abd 3:1
【解析】
(1)Ni元素原子核外电子数为28,结合能量最低原理书写核外电子排布式;
(2)① 同周期从左到右电负性增大,同主族从上到下电负性减小,由此判断[Ni(NH3)6]SO4中 H、N、O 元素的电负性大小的顺序;
SO42-中S原子的孤电子对数=(6+2-2×4)/2=0,价层电子对数=4+0=4;
等电子体是原子个数相同、价电子总数相同的微粒;
②PH3分子之间为范德华力,氨气分子之间形成氢键,增大了物质的沸点;NH3分子为三角锥形结构,分子中正负电荷重心不重合,N原子有1对孤对电子,形成3个N-H键,杂化轨道数目为4;
(3)Cu+的外围电子排布为3d10,Ni+的外围电子排布为3d84s1,Cu+的核外电子排布更稳定;
(4)由均摊法求解化学式;铜的某种氯化物不仅易溶于水,而且易溶于乙醇和丙酮,具有分子晶体的特征;
(5)由图含有a.Cu-N为配位键 b.Cu-N、C-N-H、C—H极性键d.C-C非极性键 ;
(6)根据均摊法计算晶胞中Ni、Cu原子数目。
(1)Ni元素原子核外电子数为28,核外电子排布式为1s22s22p63s23p63d84s2;
(2)① 同周期从左到右电负性增大,同主族从上到下电负性减小,由此判断[Ni(NH3)6]SO4中 H、N、O 元素的电负性大小的顺序为O>N>H;
SO42-中S原子的孤电子对数=(6+2-2×4)/2=0,价层电子对数=4+0=4,S采用sp3杂化,SO42-的立体构型是正四面体;
等电子体是原子个数相同、价电子总数相同的微粒,与 SO42-互为等电子体的微粒为CCl4等;
②PH3分子之间为范德华力,氨气分子之间形成氢键,分子间作用力更强,增大了物质的沸点,故氨气的沸点高于PH3分子的,
NH3分子为三角锥形结构,分子中正负电荷重心不重合,属于极性分子,N原子有1对孤对电子,形成3个N-H键,杂化轨道数目为4,氮原子采取sp3杂化,
故答案为:高于;氨气分子之间形成氢键,分子间作用力更强;极性;sp3;
(3)Cu+的外围电子排布为3d10,Ni+的外围电子排布为3d84s1,Cu+的核外电子排布更稳定,失去第二个电子更难,元素铜的第二电离能高于镍的;
(4)由均摊法求解化学式,铜:2×1/2=1,氯:2,化学式为CuCl2;铜的某种氯化物不仅易溶于水,而且易溶于乙醇和丙酮,具有分子晶体的特征;
(5)由图含有a.Cu-N为配位键 b.Cu-N、C-N-H、C—H极性键d.C-C非极性键,故选abd;
(6)晶胞中Ni处于顶点,Cu处于面心,则晶胞中Ni原子数目为8×1/8=1、Cu原子数目=6×1/2=3,故Cu与Ni原子数目之比为3:1。

 阅读快车系列答案
阅读快车系列答案【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C≡O | H-O | C-H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______。已知ΔH2=-58 kJmol-1,则ΔH3=______。
已知:CO中的化学键是C≡O,CH3OH的结构式为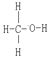 。
。
(2)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=―870.3 kJ·mol-1;
②C(s)+O2(g)=CO2(g) ΔH2=―393.5 kJ·mol-1;
③H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8 kJ·mol-1。
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH=______kJ·mol-1。
(3)中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
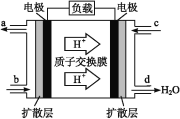
①该电池工作时,b口通入的物质为___。
②该电池正极的电极反应式为______________。
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,有____NA个电子转移。