题目内容
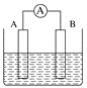
【题目】I、依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设
计的原电池如图所示。请回答下列问题:

(1)电极X的材料是___________;(填化学式)电解质溶液Y是___________;X电极上发生的电极反应为________________________________;
(2)用两个铂丝做电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,请写出负极的电极反应式____________________________在电池工作时,正极附近溶液的PH_________,(填,增大、减小或不变)
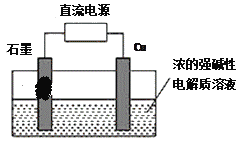
II、用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。铜电极为_________(填“阳极”和“阴极”)写出铜电极的电极反应式_______________________。
【答案】CuAgNO3Cu-2e- =Cu2+CH4 - 8e- + 10OH- = CO32- + 7H2O增大阳极2Cu +2OH-- 2e- =Cu2O + H2O
【解析】
I、(1)氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)中,失电子的金属Cu为负极,得电子的阳离子Ag+是电解质中的阳离子,所以电解质可以选择AgNO3溶液;在原电池反应2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)中,失电子的金属Cu为负极,发生失电子的氧化反应,即Cu-2e- =Cu2+;(2)用两个铂丝做电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,通入甲烷的一极为原电池的负极,电极反应式为CH4 - 8e- + 10OH- = CO32- + 7H2O;在电池工作时,通入氧气的一极发生电极反应为O2+2H2O+4e-=4OH-;附近溶液的pH增大;II、结合装置图及总电极反应式可以得知,Cu在阳极放电,生成的亚铜离子与氢氧根离子反应生成Cu2O和水,故铜电极的电极反应式为2Cu +2OH-- 2e- =Cu2O + H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案