题目内容
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C≡O | H-O | C-H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______。已知ΔH2=-58 kJmol-1,则ΔH3=______。
已知:CO中的化学键是C≡O,CH3OH的结构式为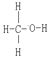 。
。
(2)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=―870.3 kJ·mol-1;
②C(s)+O2(g)=CO2(g) ΔH2=―393.5 kJ·mol-1;
③H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8 kJ·mol-1。
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH=______kJ·mol-1。
(3)中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
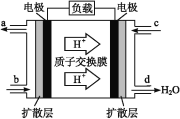
①该电池工作时,b口通入的物质为___。
②该电池正极的电极反应式为______________。
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,有____NA个电子转移。
【答案】-99 +41-488.3CH3OHO2+4H++4e-=2H2O2.4
【解析】
(1)反应热等于断键吸收的能量与形成化学键所放出的能量的差值,则根据表中数据和反应的化学方程式CO(g)+2H2(g)![]() CH3OH(g)可知反应热△H1=1076 kJ/mol+2×436 kJ/mol-3×413 kJ/mol-343 kJ/mol-465 kJ/mol=-99kJ·mol-1。根据盖斯定律可知②-①即可得到反应③,则△H3=-58 kJ/mol+99 kJ/mol=+41kJ·mol-1。
CH3OH(g)可知反应热△H1=1076 kJ/mol+2×436 kJ/mol-3×413 kJ/mol-343 kJ/mol-465 kJ/mol=-99kJ·mol-1。根据盖斯定律可知②-①即可得到反应③,则△H3=-58 kJ/mol+99 kJ/mol=+41kJ·mol-1。
(2)已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=―870.3 kJ·mol-1;
②C(s)+O2(g)=CO2(g) ΔH2=―393.5 kJ·mol-1;
③H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8 kJ·mol-1。
则根据盖斯定律可知②×2+③×2-①即得到反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH=-488.3 kJ·mol-1。
(3)①氢离子向右侧电极移动,则右侧电极是正极,左侧电极是负极,发生失去电子的氧化反应,所以该电池工作时,b口通入的物质为CH3OH。
②负极甲醇失去电子,正极氧气得到电子,由于存在质子交换膜,因此该电池正极的电极反应式为O2+4H++4e-=2H2O。
③甲醇中碳原子化合价从-2价升高到+4价,失去6个电子。12.8 g甲醇的物质的量是12.8g÷32g/mol=0.4mol,所以完全反应生成CO2时,有2.4NA个电子转移。

 高中必刷题系列答案
高中必刷题系列答案