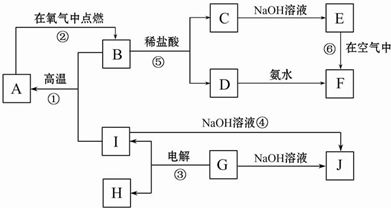
题目内容
8.下列离子方程式正确的是( )| A. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 铁与盐酸的反应 Fe+2H+═Fe3++H2↑ | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 纯碱和稀盐酸反应 CO32-+2H+═CO2↑+H2O |
分析 A.澄清石灰水中的氢氧化钙需要拆开;
B.铁与盐酸反应生成氯化亚铁和氢气;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.纯碱为碳酸钠,碳酸钠与盐酸反应生成氯化钠、二氧化碳气体和水.
解答 解:A.澄清石灰水中,氢氧化钙必须拆开,正确的离子方程式为:H++OH-═H2O,故A错误;
B.铁与盐酸的反应生成的是亚铁离子,不是铁离子,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故B错误;
C.铜片插入硝酸银溶液中生成银单质和铜离子,正确的离子方程式为:Cu+2Ag+═Cu2++2Ag,故C错误;
D.纯碱和稀盐酸反应的离子方程式为:CO32-+2H+═CO2↑+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
18.将2.8g硅粉与2.3g钠同时放入足量水中,采用恰当的方法收集反应产生的气体(全部收集).这些气体在标准
状况下的体积为( )
状况下的体积为( )
| A. | 1.12L | B. | 4.48L | C. | 5.6L | D. | 3.36L |
19.下列情况会使所配NaCl溶液浓度偏高的是( )
| A. | 定容时俯视刻度线 | |
| B. | 容量瓶用前内壁沾有水珠 | |
| C. | 加蒸馏水时,不慎超过了刻度线,用胶头滴管吸出 | |
| D. | 称量NaCl时砝码与药品放反了 |
13.下列说法错误的是( )
| A. | 配制一定物质的量浓度的NaCl溶液定容时,俯视会使溶液浓度偏大 | |
| B. | 除去氯气中HCl用饱和食盐水 | |
| C. | 海水开发用的部分过程如图:工业生产中常选用NaOH作为沉淀剂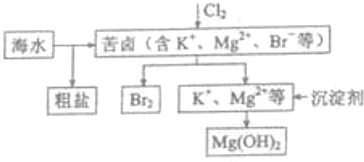 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
17.已知物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关.下列各组物质:①Cu与HNO3溶液②Al与NaOH溶液③Zn与H2SO4溶液④Mg与HCl溶液.由于浓度不同而能发生不同氧化还原反应的是( )
| A. | ③④ | B. | ①③ | C. | ①② | D. | ①③④ |
18.根据下列实验内容得出的结论正确的是( )
| 选项 | 实验内容 | 结论 |
| A | 某物质的水溶液能使红色石蕊试纸变蓝 | 该物质一定是氨气 |
| B | 某物质的水溶液中加入盐酸产生无色无味气体 | 该溶液一定含有大量碳酸根离子 |
| C | 测定同浓度Na2CO3 和Na2SO4 溶液的pH,前者大于后者 | 碳元素非金属性弱于硫 |
| D | 向沸水中逐滴加入1~2mL FeCl3饱和溶液,搅拌并继续煮沸出现浑浊 | 制备Fe(OH)3胶体 |
| A. | A | B. | B | C. | C | D. | D |