��Ŀ����
7�����ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�壮��ʴ��Һ�к��д���CuCl2��FeCl2��FeCl3�������ŷŽ����»�����Ⱦ����Դ�˷ѣ�Ӧ���ǻ������ã�ij����ʦ��ͼʾ������ʵ���ҽ���ʵ�飺�Ӹ�ʴ��Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ����Ϊ��ʴҺԭ��ѭ��ʹ�ã�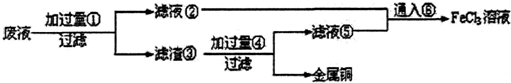
��1��д��FeCl3��Һ��ͭ��������Ӧ�Ļ�ѧ����ʽ��2FeCl3+Cu=2FeCl2+CuCl2��
��2�����鸯ʴ�����Һ���Ƿ���Fe3+Ӧ�õ��Լ���KSCN��Һ�����ѧʽ��
��3�������ˡ��õ��IJ��������У���ͨ©�������������ձ���
��4����Һ�м����������������Ӧ�����ӷ���ʽ��2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��
��5��ȡ��Һ200mL������CuCl2��FeCl2��FeCl3�����ʵ���Ũ�ȷֱ�Ϊ1.5mol/L��3.0mol/L����1.0mol/L����Ҫ��ͭȫ�����գ������Fe�۵�����Ӧ������22.4g�������Ļ�����ȫ��ת��ΪFeCl3��Һ��ͨ��Cl2�����ʵ���������0.6mol��
���� ʵ��Ŀ���ǣ��Ӹ�ʴ��Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ�������̿�֪��Ӧ���������Fe���Ȼ������Ȼ�ͭ��Ӧ�����˽��з��룬����Һ��ΪFeCl2���������к�Fe��Cu���ӹ����Լ���Ϊ���ᣬ���˵õ�����Cu����Һ���к�FeCl2��HCl��Ϊ���������ʣ������Ļ�����ȫ��ת��ΪFeCl3��Һ��������BΪ������
��1��FeCl3��Һ��Cu��Ӧ����CuCl2��FeCl2��
��2��������Һ��Fe3+����ͨ����KSCN��Һ����Һ���˵��Fe3+���ڣ�
��3�������ˡ��õ��IJ��������У���ͨ©�����ձ�����������
��4����Һ�м������Fe��Fe���Ȼ�����Ӧ�����Ȼ����������Ȼ�ͭ��Ӧ�����Ȼ�������Cu��
��5������������Fe3+��Cu2+�����ȷ�����Ӧ��2Fe3++Fe=3Fe2+��Ȼ���ٷ�����Ӧ��Cu2++Fe=Fe2++Cu����Ϸ���ʽ������Ҫ����Fe�����ʵ������ٸ���m=nM�������Fe��������
������Һ��FeCl2�����ʵ�����ͨ��Cl2ȫ��ת��ΪFeCl3��������Ӧ��2FeCl2+Cl2=2FeCl3�����ݷ���ʽ������Ҫͨ�����������ʵ�����
��� �⣺ʵ��Ŀ���ǣ��Ӹ�ʴ��Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ�������̿�֪��Ӧ���������Fe���Ȼ������Ȼ�ͭ��Ӧ�����˽��з��룬����Һ��ΪFeCl2���������к�Fe��Cu���ӹ����Լ���Ϊ���ᣬ���˵õ�����Cu����Һ���к�FeCl2��HCl��Ϊ���������ʣ������Ļ�����ȫ��ת��ΪFeCl3��Һ��������BΪ������
��1��FeCl3��Һ��Cu��Ӧ����CuCl2��FeCl2���÷�Ӧ����ʽΪ��2FeCl3+Cu=2FeCl2+CuCl2��
�ʴ�Ϊ��2FeCl3+Cu=2FeCl2+CuCl2��
��2��ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+��
�ʴ�Ϊ��KSCN��Һ��
��3�������ˡ��õ��IJ��������У���ͨ©�����ձ�����������
�ʴ�Ϊ�����������ձ���
��4����Һ�м������Fe��Fe���Ȼ�����Ӧ�����Ȼ����������Ȼ�ͭ��Ӧ�����Ȼ�������Cu�����������ӷ�ӦΪ��2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��
�ʴ�Ϊ��2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��
��5����Һ��CuCl2Ϊ0.2L��1.5mol/L=0.3mol��FeCl2Ϊ0.2L��3mol/L=0.8mol��FeCl3Ϊ0.2L��1.0mol/L=0.2mol��
2 Fe3++Fe=3 Fe2+
0.2mol 0.1mol 0.3mol
Cu2++Fe=Fe2++Cu
0.3mol 0.3mol 0.3mol
��Ҫ��ͭȫ�����գ������Fe�۵�����Ӧ������0.4mol��56g/mol=22.4g��
��Ӧ��n��FeCl2��=0.3mol+0.3mol+0.6mol=1.2mol��
��2FeCl2+Cl2=2FeCl3��֪�����Ļ�����ȫ��ת��ΪFeCl3��Һ��ͨ��Cl2�����ʵ��������� $\frac{1.2mol}{2}$=0.6mol��
�ʴ�Ϊ��22.4��0.6��
���� ���⿼������ķ��롢�ᴿ�ۺ�Ӧ�ã���ȷ��������ԭ��������Ԫ�ػ�����������ǹؼ�����5���йؼ����жϷ�����Ӧ���Ⱥ�˳�����⣬��Ŀ�Ѷ��еȣ�

 ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д�| A�� | ��ij�¶��£���Ӧ��$\frac{c��C{l}^{-}��}{c��Cl{O}^{-}��}$=11������Һ��$\frac{c��Cl{O}^{-}��}{c��Cl{{O}_{3}}^{-}��}$=$\frac{1}{2}$ | |
| B�� | �μӷ�Ӧ�����������ʵ�������$\frac{1}{2}$a mol | |
| C�� | �ı��¶ȣ�������KClO��������۲���Ϊ$\frac{1}{2}$a mol | |
| D�� | �ı��¶ȣ�������KClO3��������۲���Ϊ$\frac{1}{7}$a mol |
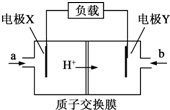 ij����ȼ�ϵ�ص�ԭ����ͼ��ʾ���õ�صĸ�����ӦʽΪ��H2-2e-�T2H+���������ж��д�����ǣ�������
ij����ȼ�ϵ�ص�ԭ����ͼ��ʾ���õ�صĸ�����ӦʽΪ��H2-2e-�T2H+���������ж��д�����ǣ�������| A�� | a��ͨ�����H2 | B�� | �������Һ������NaOH��Һ | ||
| C�� | �缫X�Ǹ����������� | D�� | Y���ķ�ӦΪO2+4e-+4H+�T2H2O |
| A�� | NaCl | B�� | LiCl | C�� | MgO | D�� | Na2S |
 �о���ѧϰ������ѧ������˼ά�����÷�����ij�о���ѧϰС�齫����װ����ͼ���ӣ�C��D��E��F���Ƕ��Ե缫������Դ��ͨ�������е����̪��Һ����F�������Ժ�ɫ��
�о���ѧϰ������ѧ������˼ά�����÷�����ij�о���ѧϰС�齫����װ����ͼ���ӣ�C��D��E��F���Ƕ��Ե缫������Դ��ͨ�������е����̪��Һ����F�������Ժ�ɫ��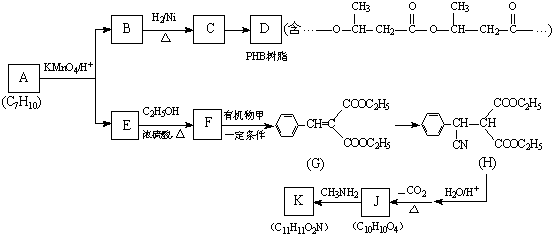
 $\stackrel{KMnO4/H+}{��}$RCOOH+
$\stackrel{KMnO4/H+}{��}$RCOOH+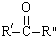
 +H2O
+H2O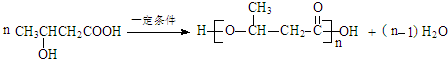 ��
��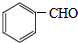 ��
�� ��
��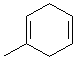 ��
��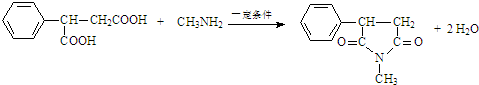 ��
��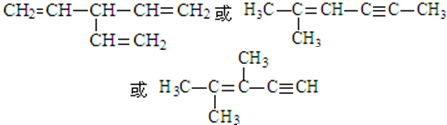 ��д��һ�ּ��ɣ���
��д��һ�ּ��ɣ���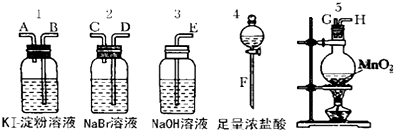
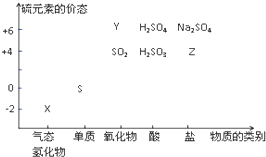 ���ʵ����ͺ���Ԫ�صĻ��ϼ����о��������ʵ�������Ҫ�ӽǣ����仯�������̬�仯Ϊ����Ķ�άת����ϵ��ͼ��ʾ
���ʵ����ͺ���Ԫ�صĻ��ϼ����о��������ʵ�������Ҫ�ӽǣ����仯�������̬�仯Ϊ����Ķ�άת����ϵ��ͼ��ʾ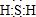 ����ˮ��Һ�ڿ����з����ױ���ǣ�д����Ӧ�Ļ�ѧ����ʽ2H2S+O2=2S��+2H2O��
����ˮ��Һ�ڿ����з����ױ���ǣ�д����Ӧ�Ļ�ѧ����ʽ2H2S+O2=2S��+2H2O�� ��
��