题目内容
3.在研究金矿床物质组分的过程中,通过分析发现了Cu-Ni-Zn-Sn-Fe多金属互化物.(1)某金属互化物属于晶体,区别晶体和非晶体可通过X-射线衍射实验方法鉴别.该金属互化物原子在三维空间里呈周期性有序排列,即晶体具有自范性.
(2)基态Ni2+的核外电子排布式1s22s22p63s23p63d8;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4 属于分子晶体.
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2.1mol(SCN)2分子中含有σ键的数目为5NA;
类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键;
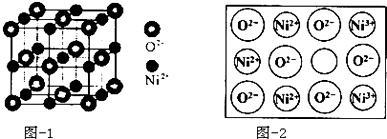
(4)立方NiO(氧化镍)晶体的结构如图-1所示,其晶胞边长为apm,列式表示NiO晶体的密度为$\frac{4×74.7}{(a×1{0}^{-10})^{3}×{N}_{A}}$g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)人工制备的NiO晶体中常存在缺陷(如图-2)
一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为1:11.
分析 (1)晶体具有自范性,原子在三维空间里呈周期性有序排列,可通过X-射线衍射实验进行鉴别;
(2)Ni元素原子核外电子数为28,核外电子排布式为1s22s22p63s23p63d84s2,失去4s能级2个电子形成Ni2+;
配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于分子晶体;
(3)(SCN)2的结构式为N≡C-S-S-C≡N,根据[(SCN)2]的结构可知分子中有3个单键和2个碳氮三键,单键为σ键,三键含有1个σ键、2个π键;
由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸;
(4)根据均摊法计算晶胞中Ni、O原子数目,进而计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度;根据电荷守恒计算Ni3+与Ni2+的离子个数之比.
解答 解:(1)晶体和非晶体可通过X-射线衍射实验进行鉴别,金属互化物原子在三维空间里呈周期性有序排列,金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于晶体,
故答案为:X-射线衍射实验;自范;
(2)Ni元素原子核外电子数为28,核外电子排布式为1s22s22p63s23p63d84s2,失去4s能级2个电子形成Ni2+,故Ni2+离子核外电子排布为:1s22s22p63s23p63d8,
Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于分子晶体,
故答案为:1s22s22p63s23p63d8;分子;
(3)(SCN)2的结构式为N≡C-S-S-C≡N,根据[(SCN)2]的结构可知分子中有3个单键和2个碳氮三键,单键为σ键,三键含有1个σ键、2个π键,(SCN)2分子含有5个σ键,故1mol(SCN)2分子中含有σ键的数目为 5NA;
由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸,
故答案为:5NA;异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键;
(4)晶胞中Ni原子数目为1+12×$\frac{1}{4}$=4,氧原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{16+58.7}{{N}_{A}}$g,晶胞边长为apm,晶胞体积为(a×10-10 cm)3,NiO晶体的密度为为4×$\frac{16+58.7}{{N}_{A}}$g÷(a×10-10 cm)3=$\frac{4×74.7}{(a×1{0}^{-10})^{3}×{N}_{A}}$g/cm3;
设1mol Ni0.96O中含Ni3+xmol,Ni2+为(0.96-x)mol,根据晶体仍呈电中性,可知 3x+2×(0.96-x)=2×1,x=0.08mol Ni2+为(0.96-x)mol=0.88mol,即离子数之比为Ni3+:Ni2+=0.08:0.88=1:11,
故答案为:$\frac{4×74.7}{(a×1{0}^{-10})^{3}×{N}_{A}}$;1:11.
点评 本题是对物质结构的考查,涉及晶体结构与性质、核外电子排布、化学键、杂化轨道、晶胞计算等,难度中等,(4)为易错点,注意利用均摊法计算晶胞质量,根据阴阳离子所带电荷相等计算氧化镍晶体中离子数目之比.

 名校课堂系列答案
名校课堂系列答案| A. | CO2和SiO2 | B. | NaCl和HCl | ||
| C. | (NH4)2CO3和CO(NH2)2 (尿素) | D. | NaH和KCl |
| A. | 电解硫酸时,阴极产生1molH2时,阳极一定产生0.5molO2 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol | |
| C. | 电解1mol熔融的Al2O3,能产生33.6L氧气、54.0g金属铝 | |
| D. | 工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上就溶解0.5NA个铜原子 |
| A. | 硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 | |
| B. | 开发核能、太阳能等新能,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 | |
| C. | 用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化 | |
| D. | 汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的 |
| A. | 草酸可使酸性高锰酸钾溶液褪色,其离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O | |
| B. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+NH3•H2O+AlO2-+2H2O | |
| C. | NaHSO3溶液与FeCl3反应的离子方程式:SO32-+2Fe3++H2O=SO42-+2Fe2++2H+ | |
| D. | NH4HCO3溶液中加入少量NaOH:NH4++OH-═NH3•H2O |
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | 常温常压下环癸五烯 是一种易溶于水的无色气体 是一种易溶于水的无色气体 | |
| C. | 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |