题目内容
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。
序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
试回答:
①实验1、2研究的是_______________对H2O2分解速率的影响。
②实验2、3的目的是_____________________________________________________。
(2)实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_____________________的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是___________。
A、硫酸钾B、硫酸锰C、水D、氯化锰
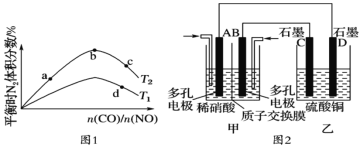
(3)实验三:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______________________________。
②定量如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_______________________________________________。
【答案】温度 比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异 催化剂或硫酸锰或Mn2+的催化作用 B 反应产生气泡的快慢 控制阴离子相同,排除阴离子的干扰 收集40mL气体所需要的时间
【解析】
实验一:(1)①实验1、2使用相同的催化剂,但温度不同,所以反应速率不同是由温度不同导致的,所以可以探究温度对H2O2分解速率的影响;
②根据实验2、3的数据可知,实验2、3的温度相同,使用的催化剂不同,则实验目的是比较FeCl3溶液和MnO2作为催化剂对双氧水分解反应速率影响的差异;
实验二:①对化学反应速率影响最快的是催化剂,故猜想还可能是催化剂的影响,或硫酸锰或Mn2+的催化作用;
②反应方程式2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑中,浓度变化较大的为锰离子,所以选择的可以做催化剂的试剂应该含有锰离子,故只有B正确;
实验三:①定性比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过观察产生气泡的快慢来比较,产生气泡快的,催化效果好;在探究Fe3+和Cu2+对H2O2分解的催化效果是:必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理,可以避免由于阴离子不同造成的干扰;
②为了更精确地研究浓度对反应速率的影响,由图可知,可以通过测定一定时间内产生的气体或测定产生一定体积的气体所需的时间来比较,一定时间内产生的气体越多或产生一定体积的气体所需的时间越短,说明反应速率越快,实验时均以生成40mL气体为准,测定收集40mL气体所需要的时间。

【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为_____.
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____,B原子的杂化轨道类型是_____.
Li、B、H元素的电负性由大到小排列顺序为_____.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJmol﹣1 | I2/kJmol﹣1 | I3/kJmol﹣1 | I4/kJmol﹣1 | I5/kJmol﹣1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____(填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____,NaH的理论密度是___________gcm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
【题目】实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
实验编号 试剂 | A | B | C |
10% H2O2/mL | 20.0 | V1 | V2 |
2 mol·L-1 FeCl3/ mL | 0 | 5.0 | 10.0 |
H2O/ mL | V3 | V4 | 0 |
按要求回答下列问题:
(1)欲用图装置来比较该反应的反应速率快慢,检查该装置气密性的方法是_______。

(2)当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测____________________推(计)算反应速率。
(3)为实现实验目的,则V4=____。
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 =2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:___________________。
(5)读数时发现,量气装置左端液面低于右端液面,则测得的气体体积_____填“偏大”、“偏小”或“无影响”)